高血糖激活神经元CCL2表达导致糖尿病相关焦虑障碍
先前已有一些研究表明糖尿病会并发焦虑症,但其确切的机制还不清楚。曾一度认为造成焦虑的原因与胰岛素相关,但通过干预胰岛素通路并没法有效缓解焦虑。而糖尿病另一大表征——高血糖,与焦虑症的关联还尚不明确。
2025年5月6日,中国科学院上海药物研究所李佳与临港实验室臧奕团队共同在期刊Nature Metabolism上发表论文 Neuronal CCL2 responds to hyperglycaemia and contributes to anxiety disorders in the context of diabetes(神经元CCL2响应高血糖并促进糖尿病相关焦虑障碍的发生),揭示了趋化因子CCL2在介导糖尿病并发焦虑症中的关键作用,明确了 “高血糖-神经元CCL2-脑区炎症” 的病理链条,为糖尿病焦虑治疗提供了全新视角,深化了对代谢紊乱与精神疾病共病机制的理解。
糖尿病引起的焦虑中CCL2分子是必须的
链脲佐菌素(Streptozotocin,STZ)造模小鼠会出现高血糖、胰岛素缺乏、体重下降以及食物和水摄入增加的症状。这种药物虽然会诱导胰岛β细胞死亡,但由于血脑屏障的存在,并不直接作用于中枢神经,因此作者选用此模型来评估糖尿病对焦虑发病的影响。作者首先通过明暗箱、高架十字迷宫和旷场等行为学实验,检测出造模小鼠出现显著的焦虑样行为,确立起糖尿病焦虑共病模型。但在实验中观测到动物运动减少,为排除由于运动对焦虑样行为结果的影响,作者进一步通过网格行走测试和跑步机疲劳测试评估小鼠的运动能力,结果发现小鼠运动协调性和耐力未发生显著改变。这些结果表明,高血糖对焦虑的影响程度大于其对运动能力的影响,因此,在后续研究中主要关注高血糖对焦虑的作用。
最近的研究表明糖尿病和精神疾病病人外周血液中包括CCL2在内的多种趋化因子水平显著上升,因此作者全面评估了STZ模型小鼠中趋化因子的变化。结果发现,小鼠大脑内侧前额叶皮质(mPFC)和腹侧海马体(vHPC)中CCL2的mRNA和蛋白质水平显著上调,同时肝脏、脂肪、肾脏及血浆中的CCL2也显著增加。进一步实验发现,全身性敲除CCL2基因在不影响小鼠行为和代谢的情况下,显著减轻了STZ小鼠焦虑样行为。这表明CCL2的系统性升高是STZ小鼠焦虑样行为的主要原因。
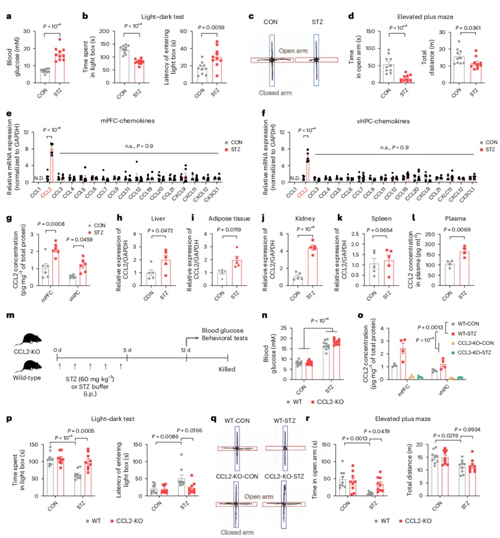
图1. CCL2的系统性升高是STZ小鼠焦虑样行为的主要原因
糖尿病引发的焦虑是由中枢而非外周的CCL2介导
为了进一步确定CCL2参与维持STZ小鼠焦虑样行为的作用区域,作者分别通过腹腔和脑室注射CCL2的中和抗体(腹腔注射中和抗体不影响脑室中CCL2水平,脑室中注射中和抗体有效降低mPFC和vHPC中CCL2水平而不影响血浆中含量),检测对STZ小鼠焦虑样行为的影响。结果表明,外周阻断 CCL2 对焦虑样行为无缓解作用,而中枢阻断 CCL2 则显著改善了焦虑样行为。这些结果表明中枢而非外周的CCL2才是介导STZ小鼠焦虑样行为的关键因子。
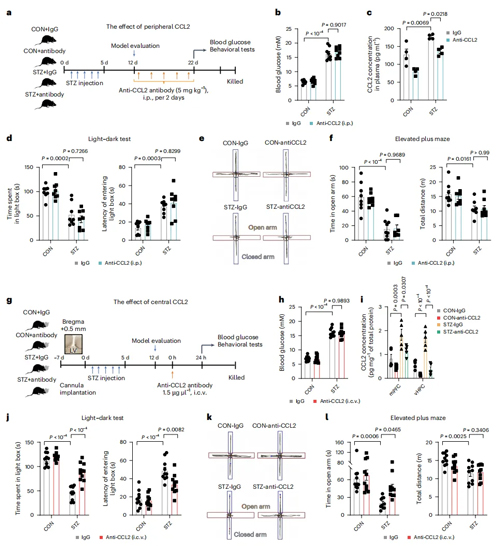
图2. 中枢而非外周的CCL2才是介导STZ小鼠焦虑样行为的关键因子
高血糖激活转录因子TonEBP
上调神经元CCL2表达
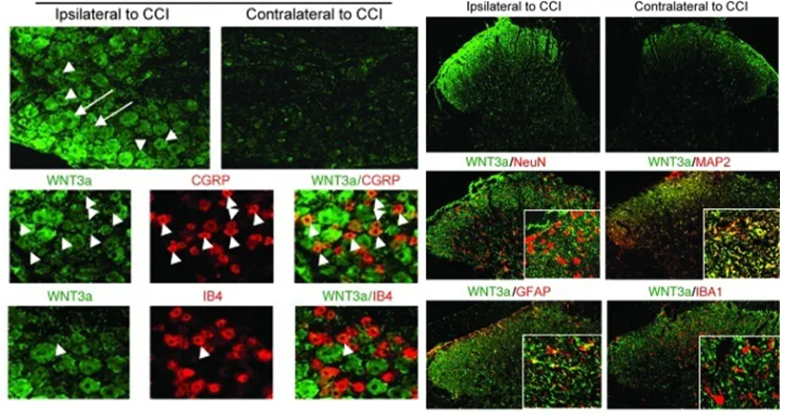
为了进一步探究焦虑STZ小鼠CCL2上调的具体细胞和分子机制,作者通过免疫荧光分析发现,情绪相关脑区中只有mPFC和vHPC中CCL2水平发生显著增加,且上调的CCL2主要表达于神经元中。
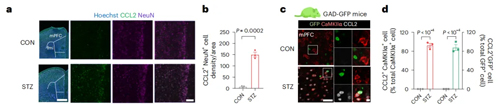
图3-1. STZ焦虑小鼠上调CCL2表达在神经元中
体外原代细胞实验发现,高糖培养引起神经元中CCL2的mRNA和蛋白质水平显著增加,且这一变化与胰岛素和瘦素无关。转录因子筛查表明,张力反应增强子结合蛋白TonEBP在STZ小鼠mPFC和vHPC脑区中显著上调。利用RNA干扰技术敲低TonEBP水平,可显著降低mPFC和vHPC脑区中CCL2表达水平,且能显著改善焦虑样行为。特异性敲除神经元中CCL2也同样缓解了STZ小鼠焦虑样行为。这些结果表明神经元可以通过TonEBP-CCL2轴整合高血糖和焦虑样行为。
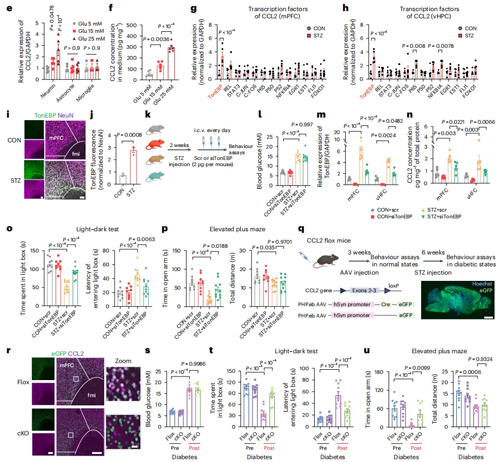
此外,作者还通过短时禁食和葡萄糖溶液灌胃进一步验证了在正常生理状态下血糖波动并不足以激活TonEBP-CCL2轴,表明这种复杂的机制只在病理条件下起作用。
上调的神经元CCL2介导神经炎性反应
免疫荧光分析发现,CCL2的受体CCR2与STZ小鼠mPFC和vHPC中的小胶质细胞和单核细胞共定位。通过遗传标记区分发现,这部分细胞中小胶质细胞占比远高于非浸润单核细胞,表明小胶质细胞是CCL2在糖尿病中的关键靶点。
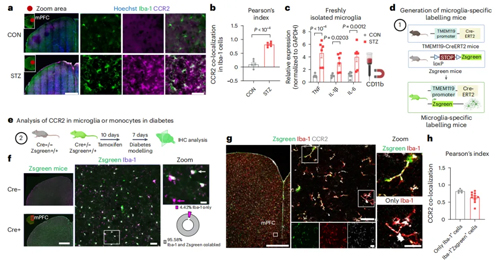
图4-1. 小胶质细胞是STZ小鼠CCL2的作用靶点
为进一步确定STZ小鼠焦虑样行为是否由小胶质细胞激活和神经炎症介导、CCL2-CCR2信号通路是否参与影响STZ小鼠焦虑样行为,作者分别利用通用神经免疫抑制剂米诺环素和CCR2口服抑制剂INCB3284处理STZ小鼠,结果发现米诺环素和INCB3284都能抑制mPFC和vHPC中的小胶质细胞激活以及小胶质细胞中细胞因子的转录,并有效缓解焦虑样行为。这些结果表明,CCL2-CCR2信号激活的神经炎症是介导STZ诱导的糖尿病小鼠焦虑样行为的关键因素。
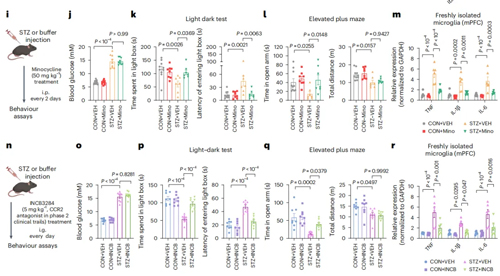
图4-2. CCL2激活小胶质细胞引发神经炎症诱导STZ小鼠焦虑样行为
TonEBP-CCL2-焦虑轴
与胰岛素信号通路无关
为了进一步模拟二型糖尿病糖的代谢紊乱特征(血糖升高、出现胰岛素抵抗和胰岛素分泌不足),排除胰岛素信号通路影响,作者建立了低剂量STZ联合高脂饮食的小鼠模型,检测发现这种小鼠同样出现了显著的焦虑样行为。
为重点探究高血糖对焦虑样行为的影响,作者选用了不依赖胰岛素的降糖药物达格列净来验证TonEBP-CCL2-焦虑轴是否在联合饮食小鼠中仍然存在。实验结果表明,达格列净不仅表现出明显的抗抑郁效果,而且显著抑制了联合饮食糖尿病小鼠mPFC和vHPC脑区中上调的TonEBP和CCL2蛋白水平以及小胶质细胞的激活。这些结果表明,糖尿病小鼠TonEBP-CCL2轴激活以及焦虑样行为表征是由高血糖而非胰岛素介导的。
接下来,作者研究了药物抑制 CCL2-CCR2 通路对联合饮食糖尿病小鼠的焦虑样行为的影响。结果发现,使用CCR2拮抗剂INCB3284干预,同样有效缓解焦虑表现并阻断小胶质细胞激活。由此可见,高血糖 - CCL2 - 焦虑轴在两种糖尿病模型中具有高度的保守性。
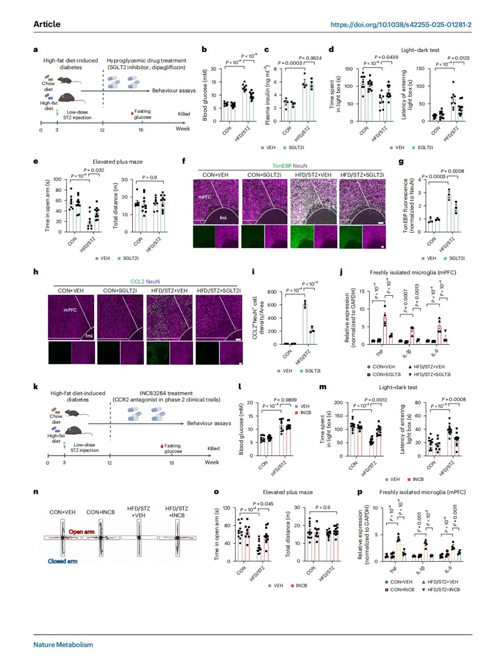
图5. TonEBP-CCL2-焦虑轴在饮食诱导的糖尿病小鼠中具有保守性,且与胰岛素信号无关
大脑区域特异性CCL2-CCR2
信号导致焦虑
为了确定神经元 CCL2 在 STZ 诱导的糖尿病小鼠焦虑样行为中发挥作用的特异性脑区,作者在系统性敲除CCL2的小鼠中特异性地在mPFC和vHPC神经元中过表达CCL2,结果发现仅mPFC或vHPC过表达以及mPFC+vHPC过表达CCL2后,小鼠焦虑样行为显著加剧,其中mPFC+vHPC过表达比仅mPFC过表达CCL2的焦虑行为更严重,且不存在性别差异。同时,CCL2的过表达还会上调炎性细胞因子mRNA水平,并表现出反应性小胶质细胞的形态学变化。这些结果表明,mPFC和vHPC神经元中的CCL2协同诱导焦虑样行为。
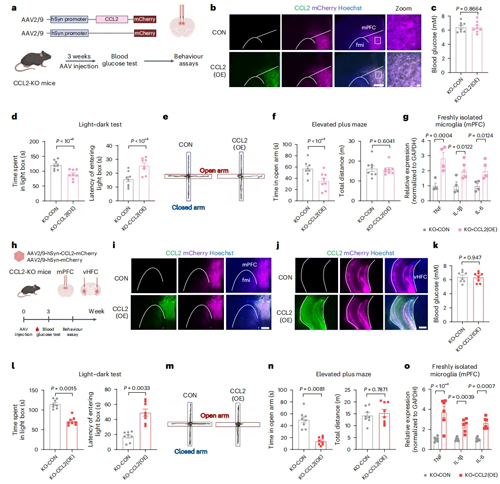
图6. mPFC和vHPC中的神经元CCL2协同诱导焦虑样行为
糖尿病患者中TonEBP-CCL2
信号轴激活与炎症反应上调
为了评估以上研究结果的临床相关性,作者继续探究了糖尿病患者神经元中的 TonEBP-CCL2 轴及相关炎症通路是否存在上调。通过对糖尿病患者进行RNA测序发现,糖尿病患者神经元中的TonEBP是CCL2 表达水平最高的诱导因子。健康个体中,神经元、内皮细胞或星形胶质细胞的 TonEBP 与 CCL2 均无相关性,而在糖尿病患者中,神经元内 TonEBP 与 CCL2 呈正相关。此外,特征性通路分析显示,糖尿病患者神经元中的炎症通路显著上调。这些结果证实糖尿病患者神经元中 TonEBP-CCL2 轴及相关炎症信号通路呈特异性激活,该发现可精准映射糖尿病个体的中枢神经系统病理变化。
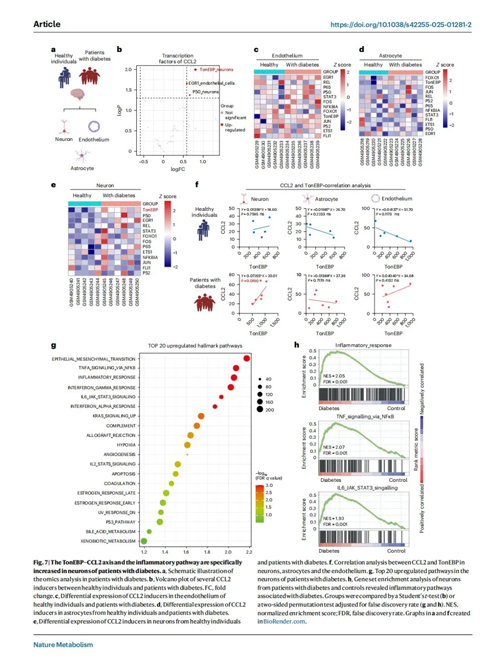
图7. 在糖尿病患者的神经元中,TonEBP-CCL2 轴和炎症通路呈现特异性增强
结论
本研究系统性地揭示了高血糖特异性激活TonEBP-CCL2-CCR2信号轴介导神经炎症,从而诱发焦虑障碍的病理机制。
具体而言,高糖激活神经元中的 TonEBP 蛋白,促使 CCL2 表达并以旁分泌方式与小胶质细胞CCR2受体结合,从而引发小胶质细胞炎症激活。这一现象在STZ和高脂饮食诱导的糖尿病小鼠中均存在,而与胰岛素信号无关。并且神经元 CCL2 诱导的焦虑样行为具有脑区特异性,在mPFC和vHPC两个核团中表现出协同致病作用。
临床样本证实,糖尿病患者神经元内 TonEBP-CCL2 轴及炎症通路显著上调。这些发现明确了 “高血糖-神经元CCL2-脑区炎症” 的病理链条,为理解糖尿病与精神共病提供了新证据。
研究方法亮点
1. 核心机制突破
首次证实神经元 CCL2 作为连接高血糖与焦虑的枢纽分子,通过 “TonEBP-CCL2-小胶质细胞激活” 轴驱动神经炎症;发现高血糖依赖转录因子 TonEBP 特异性诱导神经元 CCL2 表达,该过程独立于胰岛素信号,仅由葡萄糖浓度调控,突破传统胰岛素抵抗理论局限。
2. 跨模型验证与临床转化证据
在 STZ 诱导及饮食诱导的糖尿病模型中,均验证 CCL2 依赖的焦虑表型,且达格列净等药物可通过抑制该轴改善症状;糖尿病患者神经元中 TonEBP-CCL2 轴及炎症通路显著激活,提示靶向 CCL2-CCR2 信号的临床治疗潜力。
3. 理论创新与治疗新方向
确证中枢(而非外周)CCL2 对糖尿病焦虑行为的决定性作用,为中枢神经免疫靶向治疗提供依据,架起代谢紊乱与精神障碍的跨学科理论桥梁。
文章链接:
https://www.nature.com/articles/s42255-025-01281-2
在该研究中,作者使用瑞沃德麻醉机对小鼠实施麻醉后,利用瑞沃德脑立体定位仪完成脑室定位,继而将瑞沃德给药套管植入脑室以进行给药。此外,作者还使用瑞沃德大小鼠成年脑组织温和酶解试剂盒,对mPFC和vHPC核团的小胶质细胞进行了分离。