Ang Ⅱ诱导C57BL/6小鼠高血压造模全流程
每10秒就有1人死于高血压并发症
Ang Ⅱ 诱导高血压造模,失败率超50%?
术后存活率骤降?
血压波动失控?
问题可能藏在您忽略的 “释放精度”与“手术创伤” 里
本篇直击Ang Ⅱ诱导C57BL/6小鼠高血压造模全流程:
从 0.25μL/h 缓释泵精准植入
到术后72h黄金护理法则
再到无创动态血压监测秘笈
解决90%实验室的“重复性噩梦”
高血压造模步骤不清晰?
关键指标不明确?
看这一篇就够了
实验背景
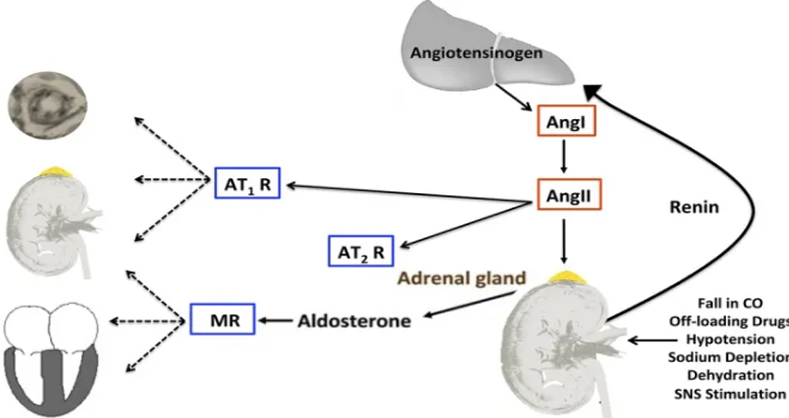
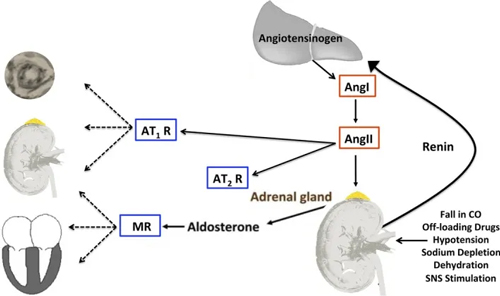
血管紧张素Ⅱ(Ang Ⅱ)是一种强效血管收缩剂,是RAAS的主要效应物,是由血管紧张素Ⅰ在血管紧张素转换酶的作用下水解产生的多肽物质。
长期暴露在高浓度的 Ang Ⅱ,可引起多种病理损伤,如心肌和血管重构、氧化应激、炎性反应、血管内皮功能障碍、肾小球损伤等[1,2]。
因此,科研中常用Ang Ⅱ进行诱发性高血压造模,这也是最广泛使用的啮齿动物高血压临床前模型之一[3,4]。
研究证实,大鼠长期皮下输注500 ng/(kg*min) Ang Ⅱ,24 h 血压开始升高,2 周血管重构,2~4 周心肌肥厚,易患鼠第 4 周可出现肾损伤[3]。
此外,C67BL/6J 小鼠 (10–12周龄, 体重20–22g),灌注 MCE Ang II,1.44 mg/kg/day,连续28天,灌注 Ang II的小鼠血压也会明显升高[5]。
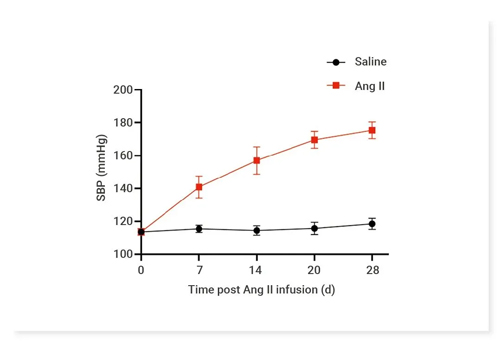
本文介绍了一种使用RWD植入式缓释泵建立C57BL/6小鼠高血压模型的方法,以期对您的实验有所助益。
实验准备
1、实验动物:SPF级雄性C57BL/6小鼠,8-10周龄,体重25~30g
2、实验试剂:Ang II、生理盐水、异氟烷、碘伏、医用消毒酒精、脱毛膏3、实验设备及耗材:
设备:麻醉机、体温维持仪、手术操作台、灭菌器、冷光源、无创血压计

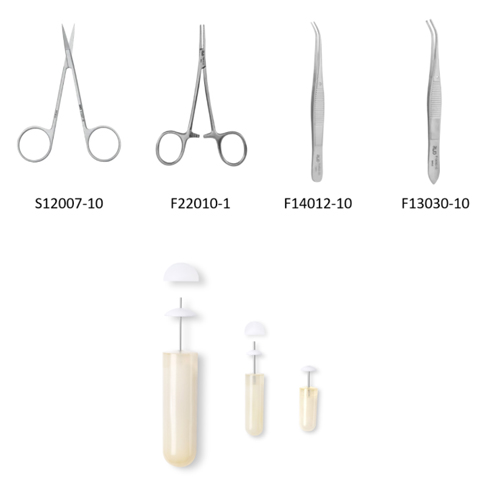
耗材:2004W植入式缓释泵、手术器械(精细剪、有齿镊、止血钳、伤口夹及缝合器)、剃毛器、0.22μm滤膜,培养皿,ep管,一次性注射器。
缓释泵型号选购表:
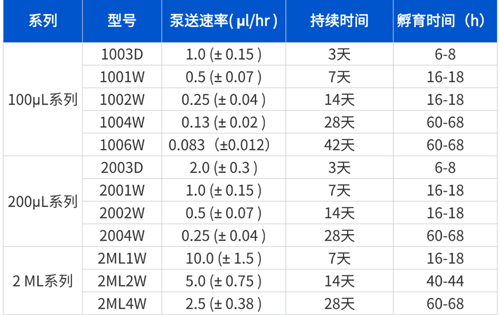
可根据既往实验自行选择合适的规格,本文以2004W为例
1003D 表示容量100μL有效工作周期三天
实验流程(以2004W为例)
1、适应性训练及血压基线测定
在缓释泵植入之前一周handle小鼠,使用计算机化尾套系统提前训练小鼠适应尾套束缚,减少应激。测定收缩压(SBP)确定血压基线。
2、药物配制
本实验采用Ang Ⅱ诱导高血压,剂量为750 ng/(kg•min)(可根据既往实验自行选择更合适的浓度)。
考虑到Ang II的药物特性,使用0.01N乙酸-生理盐水作为溶剂以维持 Ang II 的溶解度和稳定性。(也可直接用生理盐水作为对照组与溶剂)
a. 0.01 N乙酸-生理盐水(溶剂)配制
e.g.取冰醋酸(17.5 M)0.57 mL,加入1 L生理盐水(终浓度0.01N,pH≈5.0);b. Ang II 浓度计算(以 Ang II 剂量750ng/(kg•min)为例)
体重取同一批实验小鼠的体重最大值;按照药物缓释泵每批次包装标贴上的”实际泵送速率”和“容积”计算;
每小时所需 Ang II量=实验小鼠的最大体重× 60 min × 750ng/(kg•min);所需浓度=每小时所需 Ang II量/药物缓释泵速率;
总Ang II 量=所需浓度×药物缓释泵计算容积× n(小鼠数量);
溶解所需生理盐水的量=药物缓释泵计算容积× n(小鼠数量)。
3、缓释泵给药
a. 释泵称重:在灌充之前,称量空泵(带流量调节计)的重量,同时记录此时的重量数据;
b. 灌充药液:将灌充针竖直插入缓释泵,缓慢注入药液并向上抽出针头可见药液从出口溢出;
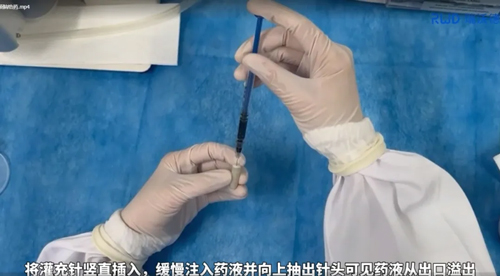
c. 再次称量缓释泵:再次称量缓释泵重量,对比两次数据,前后两次灌充的差值为灌充药液的净重;
注意:灌充量应达到产品标贴上标注的平均灌充量的90%以上。若灌充量小于缓释泵容量,则缓释泵内可能混入了空气,应抽空缓释泵并重新灌充。
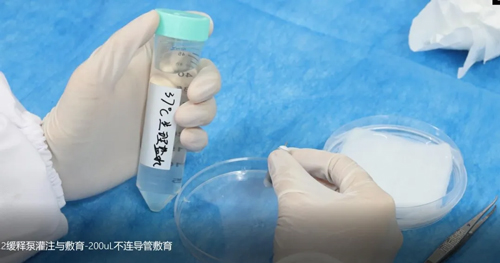
d. 缓释泵体外孵育:如果希望缓释泵立即启动,或者使用的是粘稠液体,可将泵放入37℃无菌生理盐水中敷育60-68个小时(2004W);
注意:敷育时间应视缓释泵具体型号而定(该例为2004W型号)
e. 皮下给药埋植:待动物麻醉后,两侧肩胛骨处备皮消毒,在肩胛骨之间的皮肤做一个横向切口,用止血钳分离皮下结缔组织,形成一处空隙,缓释泵出液口装上硅胶帽并将缓释泵纵向埋置进空隙中;
注意:出液口远离皮肤切口
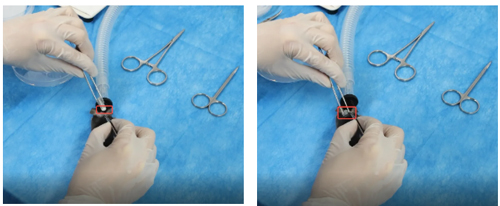
4、使用伤口夹缝合皮肤
等待小鼠苏醒后转移至饲养笼。
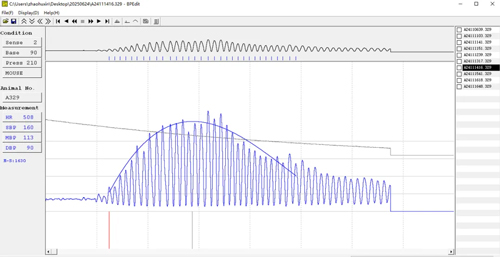
5、无创尾套血压测量
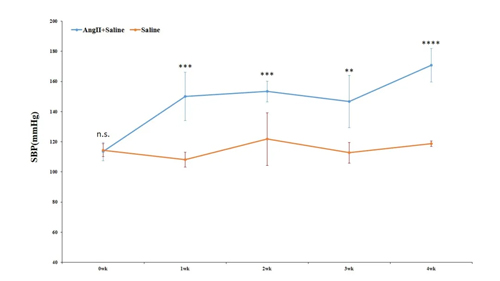
将缓释泵皮下植入后,每周监测3次血压,每次重复测试10-15次,取平均值进行记录。两个周期之间间隔5 秒。
注意:在测量血压之前,将小鼠置于加热灯下20min,实验在黑暗、安静的环境中进行。对于真实的血压测量,建议在正常睡眠后的清晨测量。
6、小鼠血液收集及EIA检测(参考) :
缓释泵埋植0、3、7、14d后,从小鼠左侧颈总动脉取血,离心(离心机半径11cm,3000r/min)15min,收集血清。血清中 Ang II水平通过Ang II EIA试剂盒检测。
7、若要确认缓释泵实际给药量(参考):
输注28天后,取出泵体。吸取泵内药液剩余量,计算小鼠输注残留量与装量比例。
术后恢复
1、碘伏清洁伤口,给药期间可通过给予青霉素预防感染;
2、定期按摩出液口以防蛋白组织等生物碎片堵塞,影响给药效果。
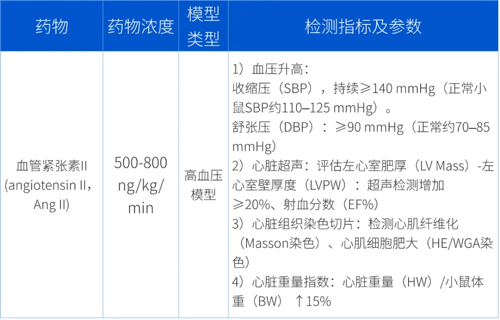
检测方法及预期实验结果
参考文献
[1]A S A .The renin-angiotensin aldosterone system: pathophysiological role and pharmacologic inhibition.[J].Journal of managed care pharmacy : JMCP,2007,13(8 Suppl B):9-20.
[2]K M A ,E C A ,Bertram P .The renin-angiotensin-aldosterone system and its suppression.[J].Journal of veterinary internal medicine,2019,33(2):363-382.
[3]A B K ,L N H ,H S P .Intrarenal ghrelin receptor inhibition ameliorates angiotensin II-dependent hypertension in rats.[J].American journal of physiology. Renal physiology,2018,315(4):F1058-F1066.
[4]李公豪,徐良成,赵艳丽,等.血管紧张素Ⅱ在心血管疾病动物模型构建中的应用进展[J].国际心血管病杂志,2023,50(02):99-103.
[5] Yang J, et al. The Long non-coding RNA MALAT1 functions as a competing endogenous RNA to regulate vascular remodeling by sponging miR-145-5p/HK2 in hypertension. Clin Exp Hypertens. 2023 Dec 31;45(1):2284658.
RWD缓释泵心血管相关造模文献 (Ang Ⅱ )
[6]Wang D ,Yu X ,Gao K , et al.Sweroside alleviates pressure overload-induced heart failure through targeting CaMKⅡδ to inhibit ROS-mediated NF-κB/NLRP3 in cardiomyocytes.[J].Redox biology,2024,74103223-103223.
[7]Shan R ,Zhang Y ,Shi Y , et al.Activation of Cannabinoid Type 2 Receptor in Microglia Reduces Neuroinflammation through Inhibiting Aerobic Glycolysis to Relieve Hypertension[J].Biomolecules,2024,14(3):
[8]Kaihao W ,Min Z ,Youhong Z , et al.IRX2 activated by jumonji domain-containing protein 2A is crucial for cardiac hypertrophy and dysfunction in response to the hypertrophic stimuli.[J].International journal of cardiology,2022,371332-344.
......