在线检测活体抗坏血酸动态变化,探究谷氨酸致抗坏血酸释放的脑细胞毒性水肿机制
化学物质参与脑内信息传递以及与脑神经相关的各种生理和病理过程。电化学分析方法能够实现脑内重要神经化学物质的活体原位和活体在线分析,因而在脑神经生理病理过程的研究中具有重要意义。生命体系的复杂性,以及分子间相互作用的多样性,对电化学传感界面的设计提出了更高的要求。在脑环境中,电极传感界面受到众多神经电活性物质和体内非特异蛋白的影响。因此,活体在线传感器的设计需充分考虑传感器的准确性、灵敏性、特异性、抗污性和生物相容性。
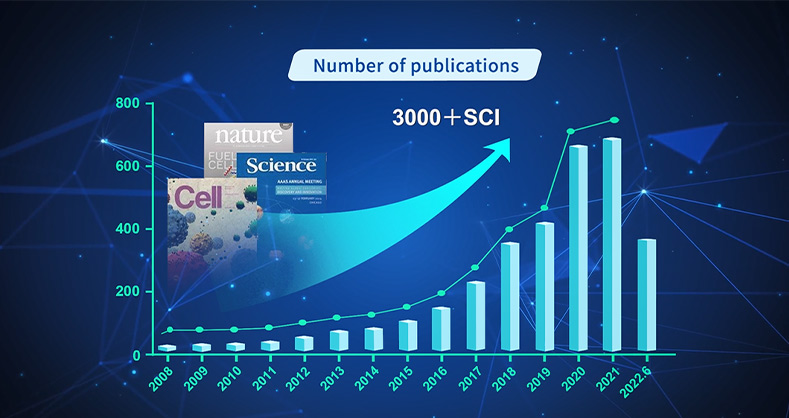
2023年5月23日重庆医科大学实验教学管理中心细胞与组织学实验室在《Research》期刊上发表题为A Novel Poly(3-hexylthiophene) Engineered Interface for Electrochemical Monitoring of Ascorbic Acid During the Occurrence of Glutamate-Induced Brain Cytotoxic Edemas的研究论文。该研究开发了一种新型传感器,将3-己基噻吩单体(3-HT)和氮掺杂多壁碳纳米管(N-MWCNTs)混合后放入未修饰的碳纤维微电极(CFME),通过慢溶剂干燥原理一步法构建复合膜改性碳纤维微电极(CFME/P3HT-N-MWCNTs)。使用该传感器分析细胞、脑片和活体大鼠脑中抗坏血酸动态变化(动态监测过程中采用瑞沃德麻醉定位注射系统)。利用该新型生物传感器首次观察了谷氨酸导致脑细胞毒性水肿释放抗坏血酸的过程并揭示了其机制。


在该研究中,作者为了制备符合使用标准的活体在线传感器,常温常压下,采用一步法将3-己基噻吩单体(3-HT)和氮掺杂多壁碳纳米管(N-MWCNTs)混合后放入未修饰的碳纤维微电极(CFME),常温处理72 h后,制成P3HT-N-MWCNTs复合膜包裹的CFME/P3HT- N-MWCNTs(图1A)。
首先,作者通过扫描电子显微镜(SEM)和透射电子显微镜 (TEM) 扫描制备的复合膜材料,发现复合膜在碳纤维表面修饰均匀(图1B),并且包裹P3HT的N-MWCNT具有更深的色调和不太明显的边缘(图1C、D),表明P3HT覆盖于碳纳米管表面,提供了有效的电荷传输途径以增强催化效果,从而能够提高电极的检测能力。而其中高角度环形暗场扫描 TEM (STEM)图像显示C、N、O 和 S 元素的均匀分布其中(图1E),由此表明P3HT在N-MWCNT上均匀分布。
随后,作者通过X射线光电子能谱(XPS)全光谱分析CFME/P3HT-N-MWCNTs的化学成分,发现电极含有丰富的氮元素掺杂(图1G),可以提高催化效率。除此之外,在电极的光谱中还观察到三配位氮(400.3 eV)的稳定氮原子结构,其对sp2碳结构产生了显著的合金化作用(图1H),可有效降低阻抗以利于电子传输。此外,图像表明该材料具有两种不同的氧元素结构,C=O (531.7 eV)和C-OH (533.6 eV)(图1I),这与材料潜在的亲水性能有关。以上特征表明 N-MWCNTs和P3HT薄膜在碳纤维(CF)基底上进行了共修饰。
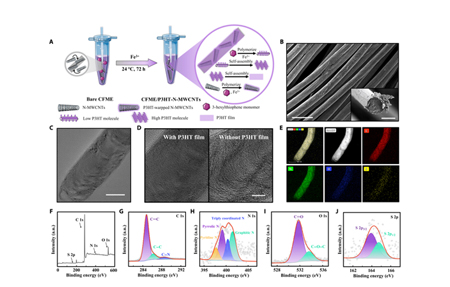
接下来,为了探究制备的CFME/P3HT-N-MWCNTs对抗坏血酸(AA)的电化学性能,作者对未修饰的CFME和P3HT-N-MWCNTs修饰的CFME电化学性能进行比较,发现CFME/P3HT-N-MWCNTs氧化电流的峰值范围在155-260 nA之间,且氧化峰位置提前(+0.4 V→+0.2 V)。表明电化学氧化AA的能力显著提高(图2B)。此外,CFME/P3HT-N-MWCNTs还表现出对AA浓度均匀增加的稳定响应(图2C),由此反映了电极良好的灵敏度和稳定性。
电化学阻抗谱(EIS)结果显示,相比较于未修饰的CFME,单独P3HT薄膜提高了阻抗水平,而P3HT-N-MWCNT复合膜改性策略大大降低了阻抗(图2D)。当CFME/P3HT-N-MWCNTs置于含2 mM AA的脑脊液中,随着扫描速率的增加,循环伏安(CV)图中阳极峰略微正向移动,阴极峰负向移动(图2E)。表明AA在CFME/P3HT-N-MWCNTs表面发生了快速可逆的氧化还原反应。此外,阳极尖峰电位的微小正向变化表明AA氧化反应有动力学极限的趋势,并且阳极和阴极峰值电流均与扫描速率(75 -175 mV/s)呈线性关系(图2F)。由此证明CFME/P3HT-N-MWCNTs与AA之间的传质和界面载荷传递是由表面吸附控制的过程。
综上所述,P3HT-N-MWCNT复合膜的修饰使CFME传输电子的能力得到了提高,有利于AA电催化氧化的动力学。
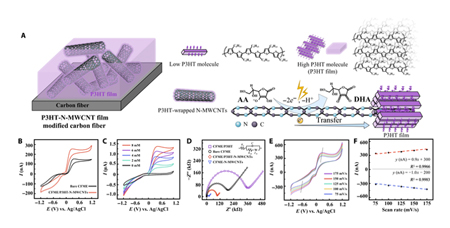
图2:CFME/P3HT-N-MWCNTs的电催化机理和电化学行为
为了判断电极是否适合用于生物监测,作者对CFME/P3HT-N-MWCNTs的AA检测的线性、选择性、稳定性、抗污性和生物相容性进行检测。研究结果表明,CFME/P3HT-N-MWCNTs的线性检测在生理AA浓度范围内(10-400 μM, I/nA = 0.06CAA/μM-0.5, R2 = 0.996)满足实际应用中的性能要求。同时,CFME/P3HT-NMWCNTs在调整检测电位后对AA具有极高的选择性(图3C和图3D)。
随后, CFME/P3HT-N-MWCNTs在碰撞试验中展现出良好的柔韧性和刚性,不会因外力而严重损坏。在稳定性测试方面,CFME/P3HT-N-MWCNTs对大鼠脑脊液中的AA(500 μM)可以稳定响应12小时,并且总电流与初始电流几乎相同,证明电极具有持久、稳定和灵敏的响应。
接下来,通过评估材料的亲水性(图3J、K)、回收细胞培养基污染耐性(图3L)、牛血清白蛋白(BSA)污染动力学测定之后发现CFME/P3HT-N-MWCNTs对AA始终保持平滑的电化学信号。在BSA处理后植入脑组织2小时,CFME/P3HT-N-MWCNTs电极检测到的AA信号稳定,并且其灵敏性没有明显下降(图3N)。证明P3HT-N-MWCNT复合膜修饰的CFME具有良好的抗污性。
最后,研究团队通过对传感界面的细胞毒性和组织相容性进行了评估,证明电极生物安全性良好。
综上证据表明CFME/P3HT-N-MWCNTs适用于生物传感,为活体组织的持续监测奠定了坚实的基础。
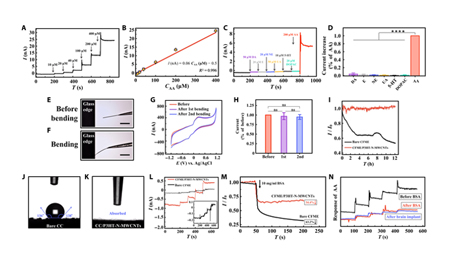
经过多种测试后,研究团队证明CFME/P3HT-N-MWCNTs具有良好的性能,接下来作者将电极应用于分析AA在大鼠大脑中的释放过程。
首先,研究团队在细胞水平利用CFME/P3HT-N-MWCNTs探究了谷氨酸致AA释放的机制。有研究表明用神经系统中常见的兴奋性氨基酸——谷氨酸处理细胞后,细胞会发生显著肿胀,并且当其在大脑中的含量增加时,导致细胞间液中AA浓度的增加。为探究二者关系,研究团队将电极插入HT22的培养皿中,当开始输注500 μM谷氨酸时,HT22细胞出现明显肿胀(图4 A和B),电极检测到显著的AA信号。结果表明,当发生细胞毒性水肿时,可以使用 CFME/P3HT-N-MWCNT在真实的细胞环境中监测AA。
随后,研究团队将CFME/P3HT-N-MWCNT的尖端完全植入脑切片的纹状体。在1小时内对脑片进行持续电化学监测,证明了电极的稳定性良好。并且研究团队将1mM AA和孵育溶液注入灌流槽中,监测到脑组织中抗坏血酸浓度持续升高,证明CFME/P3HT-N-MWCNT对脑组织中的AA敏感。为了复刻疾病或生理情况引起的大脑间质液中谷氨酸水平的波动,将脑切片放入孵育溶液中后,通过微量注射泵从左侧向右侧注射100 μM谷氨酸,通过CFME/P3HT-N-MWCNT 发现脑切片中AA浓度迅速增加至生理浓度的2.13±0.40倍,然后逐渐下降至稳定水平(图4E)。而后研究者在电极植入部位附近使用显微注射泵(RWD,R-480)注入抗坏血酸氧化酶 (AAox)快速氧化抗坏血酸(AA),灌流谷氨酸后,AA含量仅为 1.10 ± 0.29 倍。此外,在-0.10V电位下,抗坏血酸未被电化学氧化,谷氨酸注射前后的脑切片中未观察到AA信号。当脑切片用+0.01 V的孵育溶液灌注时,电流仅为生理状态的1.13±0.02倍,没有观察到AA的显著释放。因此表明100 μM谷氨酸可诱导产生显著的抗坏血酸释放。
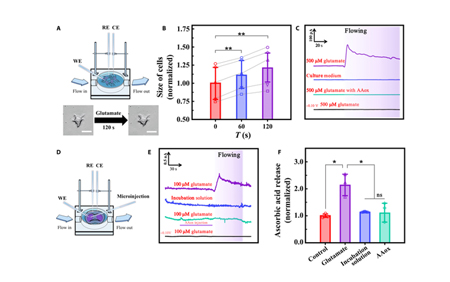
图4:实时监测通流槽中神经细胞和脑切片的AA释放
以上结果证明谷氨酸通过激活NMDA受体诱导细胞毒性水肿发生,最终造成AA释放。由此为脑水肿早期病理变化的机制、谷氨酸的神经兴奋性毒性以及谷氨酸诱导的细胞毒性水肿的动力学提供了新的证据。
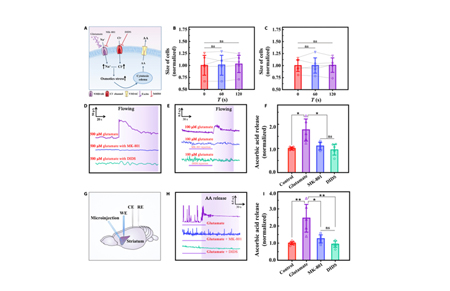
图5:探讨谷氨酸引起水肿脑细胞间液AA变化的可能机制
本文第一作者为重庆医科大学第二临床学院本科生孟泽暄、重庆医科大学研究生院张玉婵副教授、重庆医科大学儿科学院本科生杨露、重庆大学生物工程学院研究生赵爽。
通讯作者为重庆医科大学实验教学管理中心细胞与组织学实验室臧广超副教授和重庆大学生物工程学院王贵学教授。
瑞沃德麻醉定位显微注射系统
01 动物麻醉系统

麻醉过程稳定可控
主机一体化设计,无需安装
双通道独立控制
低应激诱导麻醉,符合动物福利
主动回收系统防止废气泄露
02 立体定位注射系统

精准稳定
种类齐全
功能丰富,高效便捷
适配多种实验场景
03 显微操纵系统


重复定位精度高
人性化设计
操作系统智能简便
适用于多种实验场景