脑缺血性中风研究新进展!Cell Metabolism:LRP1调控ARF1 K73乳酸化修饰影响星形胶质细胞线粒体外排
脑缺血性中风是一种严重的神经系统疾病,一旦脑部血液供应中断则会导致神经元损伤和功能障碍。当前,高血压、肥胖和糖尿病等危险因素不断增加,再加上人口老龄化,使得缺血性中风对社会的负担持续增加。
在此背景下,中枢神经系统中星形胶质细胞 - 神经元细胞间的线粒体传递值得被关注。因为它对于维持神经元细胞的有氧呼吸和能量供给具有重要的意义,并且靶向线粒体转移的干预手段在疾病的预防与治疗中展现出了较好的应用潜力。因此,关于星形胶质细胞如何通过调节线粒体转移来减轻脑缺血性中风的机制亟待进一步探索与挖掘。
2024年6月14日西南医科大学附属医院神经外科江涌教授联合四川大学华西医院李涛教授和中国科学技术大学曹洋教授在国际知名学术期刊《细胞代谢》(Cell Metabolism,IF: 27.7,五年平均IF: 31.2)上发表了题为Astrocytic LRP1 enables mitochondria transfer to neurons and mitigates brain ischemic stroke by suppressing ARF1 lactylation 的最新研究成果。文章系统解析了低密度脂蛋白相关受体蛋白1(LRP1)对星形胶质细胞线粒体转运的重要调控作用,首次揭示了LRP1通过调节细胞代谢影响ARF1乳酸化修饰,进而调控星形胶质细胞-神经元细胞间线粒体转移的作用机制。

既往文献报道LRP1参与神经系统的稳态调控,在临床前研究有一定的结果。为了探究LRP1对星形胶质细胞线粒体转运的重要调控作用,江涌教授团队借助慢病毒转染构建了LRP1敲减的星形胶质细胞原代细胞和细胞系,通过离心收集细胞培养基中的线粒体,证实LRP1缺失后培养基中的线粒体数量明显减少,但其功能并未受到显著影响。进一步的氧-糖剥夺(OGD)实验证实,LRP1介导的线粒体外排在星形胶质细胞保护神经元免受损伤过程中发挥重要作用。团队进一步发现LRP1的缺失并不影响既往已报道的机制通路,说明LRP1调控星形胶质细胞线粒体外排的过程可能存在新的机制。
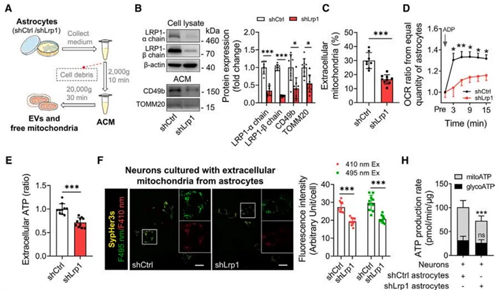
图1:敲低星形胶质细胞LRP1基因抑制其线粒体转移
进一步探究LRP1调控星形胶质细胞线粒体外排新机制,梳理出既往文献报道,LRP1参与调控中枢神经系统的代谢稳态。为了明确LRP1对星形胶质细胞代谢的影响,研究成员通过代谢组学联合13C同位素标记方式证实,LRP1参与调控星形胶质细胞的葡萄糖摄取进而影响乳酸的生成。并进一步证实LRP1调控的乳酸代谢影响星形胶质细胞的线粒体外排过程。团队通过免疫共沉淀和乳酸化修饰点抗体证实ARF1 Kla73在LRP1缺失后发生了显著改变,并进一步通过点突变的干预方式明确ARF1 K73的乳酸化修饰参与调控了星形胶质细胞线粒体外排。接下来团队又通过动物模型,注射AAV干预LRP1的表达并过表达ARF1乳酸化修饰突变体,验证出小鼠脑脊液中星形胶质细胞来源的线粒体数量下降。
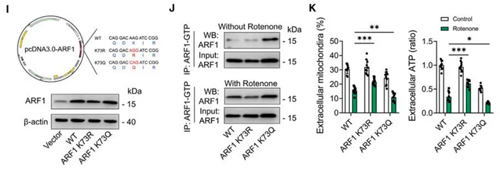
图2:ARF1-Kla 73点突变验证乳酸化修饰参与调控
接下来,团队通过建立脑缺血动物模型(大脑中动脉闭塞MCAO,线栓法),验证LRP1诱导的线粒体转移是否能保护脑缺血损伤。团队借助7.0T 磁共振、行为学评估和共聚焦显微镜证实了LRP1-ARF1 Kla73轴在调控星形胶质细胞线粒体转运中的重要作用。最后,团队通过脑卒中患者临床样本进一步验证了其研究发现。
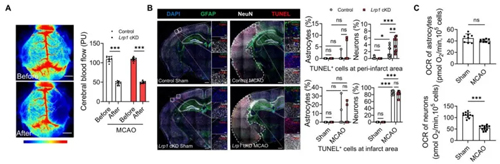
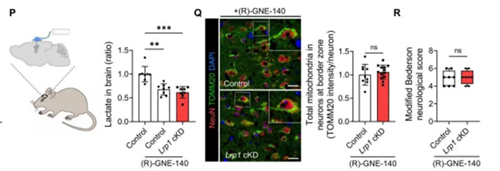
图3:大脑中动脉闭塞(MCAO)造模及持续给药
(作者用到瑞沃德MCAO线栓、激光散斑血流成像系统及缓释泵,分别用来构建MCAO模型、监测脑血流变化与持续给药)
综上,该研究揭示了星形胶质细胞通过 LRP1 - ARF1 轴调节线粒体转移来减轻脑缺血性中风的新机制,为脑缺血性中风的治疗提供了新的靶点。为未来进一步探索 LRP1 调节 ARF1 乳酰化的具体分子机制,以及如何将这一发现转化为临床治疗策略提供了方向。
研究方法亮点
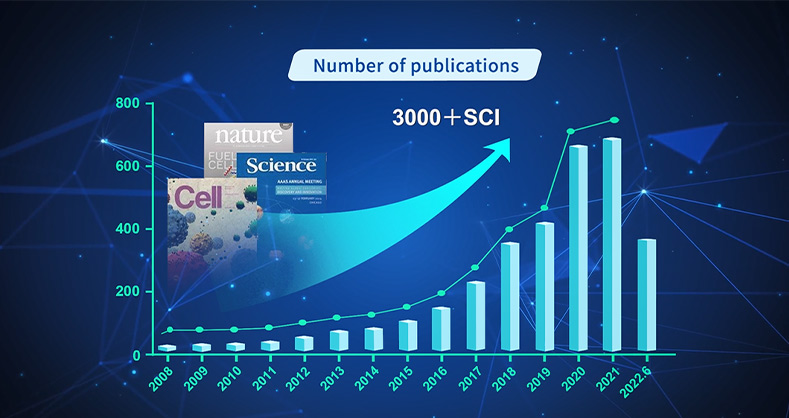
这项工作通过研究星形胶质细胞(Astrocyte)中的相关分子(LRP1),深入探索其在促进线粒体向神经元转移过程中的作用,为理解脑缺血性中风的细胞层面机制提供新视角。对分子机制进行了深入的挖掘,研究关注于 ARF1乳酸化的抑制作用,揭示了一种新的分子调控途径在脑缺血性中风中的作用。并且通过构建脑缺血性中风的动物模型,在体内环境下验证了所提出的机制和相关分子的作用,增强了研究结果的临床相关性和可靠性。在该研究中,研究人员采用了瑞沃德生产的单细胞悬液制备仪、激光散斑血流成像系统、MCAO线栓、缓释泵与颅内滞留针,为实验的顺利开展提供了支持。此外,瑞沃德还可提供的该研究所涉及的原代细胞提取、动物手术造模、动物给采样以及动物活体成像等实验技术的完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球2500+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。