睡眠开关在哪里?多篇高分文献来揭示!
睡眠是人体的一种主动过程,可以恢复精神和解除疲劳。充足的睡眠、均衡的饮食和适当的运动,是国际社会公认的三项健康标准。医学研究表明,偶尔失眠会造成第二天疲倦和动作不协调,长期失眠则会带来注意力不能集中、记忆出现障碍和工作力不从心等后果。睡眠不足可能会导致精神类疾病(例如抑郁症)、退行性疾病(例如阿尔兹海默症)、免疫力下降、心血管疾病以及代谢紊乱(肥胖、糖尿病),而成年人通常需要7-9小时的睡眠时间(此刻科研人员留下了心酸的泪水)。

经典的睡眠调控模型认为,睡眠的调节分为两个方面,昼夜节律和睡眠稳态。昼夜节律通过内在的生物钟控制一天中睡眠觉醒的时间;睡眠稳态主要由睡眠压力进行调控,控制机体获得一定的睡眠量。而对于睡眠-觉醒之间的机制研究,科学家们有以下新发现。
01
“困意”究竟如何在脑中产生

http://science.sciencemag.org/
中科院脑科学与智能技术卓越创新中心(神经科学研究所)的徐敏研究组与北京大学李毓龙研究组,合作揭示了“困意”究竟是如何在脑中产生的。
他们发现细胞外腺苷含量在清醒时高,而在非快速睡眠(NREM)时低。使用光纤记录系统检测新型腺苷探针的荧光变化,科学家们可以看到小鼠在NREM期每0.1秒之内发生的快速变化。他们首次发现,腺苷在快速眼动睡眠时期也存在很高的浓度,并且高于清醒和非快速眼动期。不仅如此,他们还观察到,腺苷浓度在睡眠不同时期的转变存在快速的变化,这意味着神经元活动与腺苷浓度密切相关。
利用钙成像和光遗传学等技术,他们在小鼠的基底前脑区(BF)找到了负责调控腺苷释放的两类神经元:乙酰胆碱能神经元和谷氨酸能神经元,其中谷氨酸能神经元的活动是引起胞外腺苷积累的主要原因。选择性地切除BF谷氨酸能神经元后细胞外腺苷的增加明显减少。此外,选择性损伤BF谷氨酸能神经元的小鼠表现出睡眠稳态调节受损,在活动期觉醒明显增加。
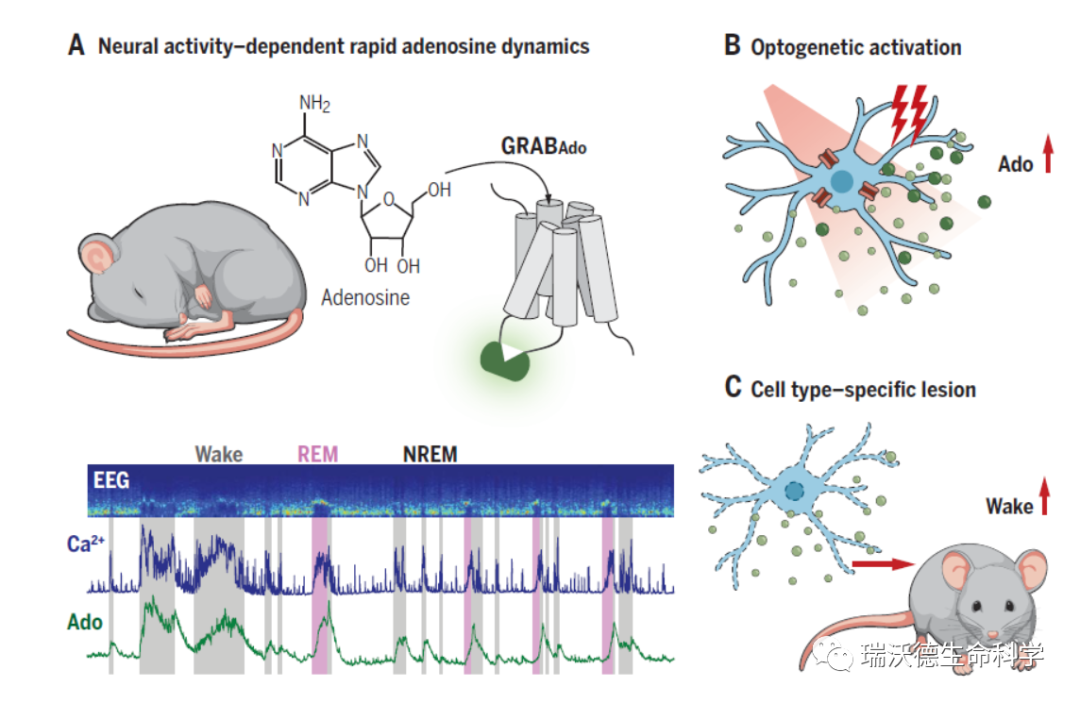
Neural control of rapid adenosine dynamics and sleep homeostasis. (A) Simultaneous optical recording of the Ca2+ activity and adenosine concentration using GCaMP and GRABAdo reveals neural activity–dependent rapid adenosine dynamics in the mouse basal forebrain (BF) during the sleep-wake cycle. (B) Optogenetic activation of BF glutamatergic neurons evokes a robust increase of extracellular adenosine. (C) Cell type–specific lesion of BF glutamatergic neurons significantly increases wakefulness.
02
黑质网状部(SNr)的特定神经元共同调
控“睡眠-觉醒”的大脑状态和运动行为

http://science.sciencemag.org/
美国加州大学伯克利分校Yang Dan研究组,中科院自动化所韩华团队和韩国科学技术院Se-Bum Paik团队共同发现,黑质中存在一个睡眠和运动的共同控制枢纽。黑质中的GABA能神经元整合大范围的输入,并通过侧支投射激活多个促进觉醒和运动控制回路。
通过对小鼠的笼养行为进行分析,可以确定四种具有不同水平的大脑唤醒和运动活动的状态:运动、非运动、安静的清醒和睡眠。结合光遗传和在体电生理技术,他们发现睡眠-觉醒的大脑状态和运动行为是由黑质网状部(SNr)的特定群体神经元共同调控的。谷氨酸脱羧酶2(GAD2)而非小清蛋白(PV)阳性神经元亚群在低运动活动和觉醒状态下优先活跃,它们的激活或失活分别会影响自然行为转变的方向,并且促进或抑制睡眠。SNr外侧PV神经元在高运动活动状态下放电率较高,其激活或失活则会增加或减少了运动终止。SNr内侧GAD2神经元在低运动活动状态下优先活跃,在抑制运动的同时,它们的激活有力地增强了从清醒到睡眠的过渡。
03
蓝斑核(LC)-去甲肾上腺素(NE)的活动
对于睡眠觉醒以及活动应激的具体调控作用

http://advances.sciencemag.org/
睡眠的一个显著特征是对外界刺激的反应性降低,但介导觉醒的相关机制仍不清楚。已有研究提示蓝斑核(LC)去甲肾上腺素(NE)活性对睡眠觉醒以及活动应激的调控作用。
以色列特拉维夫大学团队使用电生理学、行为学、药理学和光遗传学技术以及听觉刺激对行为自由的大鼠进行测试。他们发现,去甲肾上腺素(NE)的减少,降低了声音唤醒(SEAs)的概率。光遗传学激活LC促进觉醒,在睡眠觉醒过渡、脑电图去同步化和瞳孔扩张反应中十分明显;相反抑制LC活动引起瞳孔收缩。LC的短暂失活降低了NREM期发生SEAs的可能性。因此,LC-NE的活动决定了感觉唤醒的可能性,而它在睡眠期间的减少是介导行为无反应的关键因素。
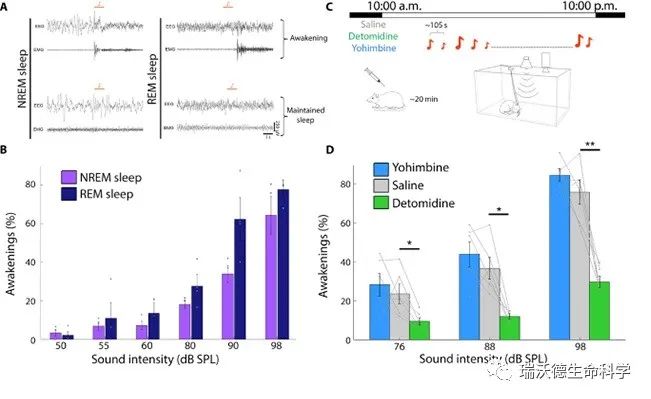
Fig. 1. Lower NE signaling decreases the probability of SEAs from NREM sleep. (A) Representative EEG and EMG traces showing immediate awakenings (top) versus maintained sleep (bottom) after auditory stimulation (4-kHz pure tone, 1-s duration; orange bars) in NREM sleep (left) and REM sleep (right). (B) Probability of awakenings (%) as a function of sound intensity in NREM sleep (purple) and REM sleep (dark blue). Gray circles show individual subject data (n = 4 rats). (C) Schematic of experimental setup for rat arousal threshold experiments (each lasting ~12 hours during lights on periods, with ~400 tone pips presented every 105 s on average). Sounds were delivered intermittently from speaker on top, while animals were continuously monitored with EEG, EMG, and video. In pharmacological experiments, NE drugs were injected intraperitoneally at lights on (10:00 a.m.). (D) Probability of awakenings (%) as a function of sound intensity in NREM sleep following administration of detomidine (α2 agonist, lower NE; green), yohimbine (α2 antagonist, higher NE; blue), or saline (gray). Note that lower NE decreases awakening probability. Two-way repeated-measures (RM) ANOVA, followed by post hoc t tests corrected with false discovery rate (FDR) *P < 0.05 and **P < 0.01 in n = 6 rats.
04
腹侧苍白球对于觉醒和动机的调节作用

https://doi.org/10.1038/s41380-020-00906-0
复旦大学黄志力课题组在之前的研究基础上(伏隔核中的D1受体和D2受体阳性神经元分别调控觉醒和睡眠)探究腹侧苍白球(VP)对于觉醒和动机的调节作用。使用光纤记录方法发现,腹侧苍白球中抑制性GABA能神经元在觉醒期活性升高,而在睡眠期降低,提示GABA能神经元可能调控觉醒,变性或抑制此类神经元则可能显著降低觉醒并抑制动机行为。
作者应用化学遗传学和光遗传学技术研究VP GABA能神经元在启动或维持觉醒中的潜在因果作用,在体实验中使用光遗传学刺激受腹侧被盖区(VTA)支配的VP GABA能神经元,通过解除VTA多巴胺能神经元的抑制,强烈促进觉醒。体外实验显示VP GABA能神经元原则上抑制VTA GABA能神经元,但也抑制VTA多巴胺能神经元。此外,光遗传学刺激VP GABA能神经元末端实验显示,它们通过支配外侧下丘脑而促进觉醒,但对中丘脑或外侧缰核无效。
文章系统地阐明了伏隔核-腹侧苍白球-中脑腹侧被盖区调控动机行为和觉醒的神经环路,表明VP – GABA能神经元是觉醒和动机行为的整合中枢,对于动机相关的觉醒必不可少。
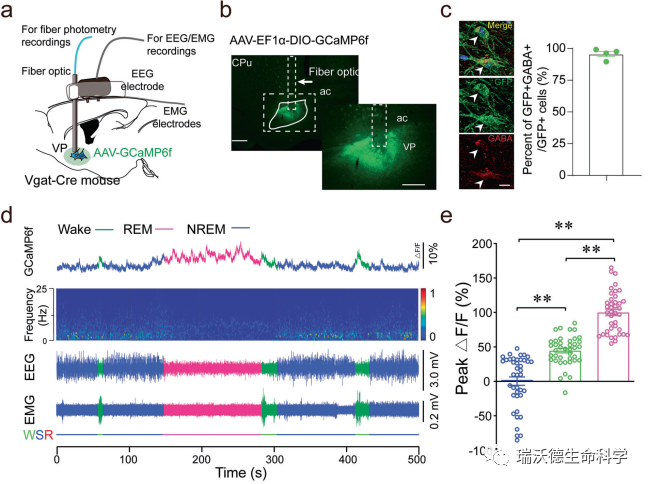
Fig.1 Population activity of VP GABAergic neurons across sleep–wake states. a Schematic of in vivo fiber photometry recordings. b Unilateral viral targeting of AAV-EF1α-DIO-GCaMP6f into the VP of a Vgat-Cre mouse. Right: Viral expression of GCaMP6f and the placement of the fiber-optic probe in the VP. Scale bar = 200 μm. c GFP-expressing cells were GABA-positive. Scale bar= 20 μm (n= 4 mice). d Representative fluorescent traces, relative EEG power, and EEG/EMG traces across spontaneous sleep–wake states. e ΔF/F peaks during wakefulness, NREM sleep, and REM sleep. The fluorescent peak values were normalized by the mean ΔF/F peaks during NREM sleep (n = 4 mice, ten sessions per mouse, **P < 0.01, one-way ANOVA followed by Tukey’s post-hoc test).
05
哺乳动物睡眠/觉醒新神经通路
---SCNGABA-CRF-LHAORX

http://advances.sciencemag.org/
在哺乳动物中,位于大脑视交叉上核(SCN)神经元中的中央昼夜节律时钟调节着睡眠-清醒周期。尽管人们已经明确SCN在调节睡眠/觉醒方面的重要性,但对于来自SCN的神经元投射对于睡眠/觉醒的调控作用还未清楚。
日本名古屋大学神经科学部研究小组发现了一条新的神经通路,它将哺乳动物的昼夜生物钟、压力和清醒联系在一起。该团队发现了一种被称为皮质激素释放因子(CRF)的神经元,当哺乳动物处于压力之下时,这种神经元会变得过度活跃,从而可能引发失眠和其他睡眠障碍。
光遗传学激活CRF神经元通过外侧下丘脑(LHA)的食欲素神经元(Orexin)促进觉醒。体内钙离子记录显示,CRF神经元在觉醒开始时处于活跃状态。此外,使用化学遗传学抑制CRF神经元可以减少运动活动和清醒状态时间。钙成像结果显示,CRF神经元活性受到SCN中GABA能神经元的负性调节。
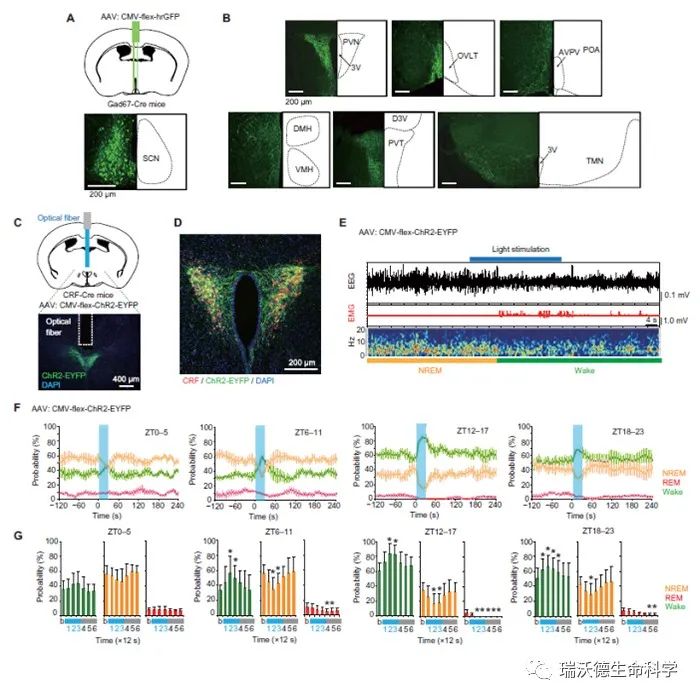
Fig. 1. Optogenetic stimulation of the CRF neurons in the PVN promotes wakefulness. (A) Schematic drawing of anterograde tracing experiment (top) and fluorescence image of the SCN in a GAD67-Cre mouse injected with AAV-CMV-flex-hrGFP (bottom). (B) Fluorescence images of several brain areas in a GAD67-Cre mouse with AAV-CMV-flex-hrGFP injected into the SCN. (C) Schematic drawing of optogenetic activation experiment in vivo and fluorescence image of the PVN in a CRF-Cre mouse injected with AAV-CMV-flex-ChR2-EYFP. (D) A fluorescence image of ChR2-EYFP (green), CRF (red), and DAPI (4′,6-diamidino-2-phenylindole) (blue) of the PVN in a CRFCre mouse. (E) A representative example of the electroencephalography (EEG) and electromyography (EMG) traces, together with the EEG power spectrum. The blue bar indicates light stimulation (10 Hz for 30 s). (F) Probability of wakefulness and NREM and REM sleep before, during, and after blue light stimulation (mean ± SD). Blue shading areas indicate light flashing. (G) Statistical results of the probability of a vigilant state before (indicated as “b”), during, and after blue light stimulation. The mean probability during 12 s (three epochs) obtained from (F) is shown in the bar graphs (mean ± SD; n = 5). Blue characters (1 to 3) indicate during stimulation (*P < 0.05 versus baseline; one-way repeated-measures analysis of variance with post hoc Tukey-Kramer test, or Friedman test with post hoc Steel-Dwass test). PVT, paraventricular thalamus; OVLT, organum vasculosum laminae terminalis; AVPV, anteroventral periventricular nucleus; VMH, ventromedial hypothalamus; D3V, dorsal part of the third ventricle.