CALM通过选择性促进突触表面Ca2+通透型AMPARs的内吞来控制长期突触可塑性
文章概述
AMPA型谷氨酸受体(AMPARs)介导着快速的兴奋性神经传递,其在突触表面的可塑性调节决定了突触强度。不同亚基组成的AMPAR在突触长时程增强(long-termpotentiation,LTP)和抑制(long-termdepression,LTD)中发挥着不同的作用,这是经验依赖的学习和记忆形成的重要细胞基础。介导突触表面Ca2+通透型的(Ca2+-permeable,CP;GluA1同聚体)AMPAR亚基和非Ca2+通透型的(Ca2+-impermeable,IP,GluA1/2或GluA2/3异聚体)AMPAR亚基选择性内吞的调节机制在很大程度上仍然是未知的。2022年5月25日,莱布尼茨分子药理学研究中心的研究人员在《Science Advances》期刊上发表题为“Selective endocytosis of Ca2+-permeable AMPARs by the Alzheimer’s disease risk factor CALM bidirectionally controls synaptic plasticity”的文章,该研究报道了网格蛋白装配淋巴样髓系白血病蛋白(Clathrin Assembly Lymphoid Myeloid Leukemia Protein, CALM;一个已知的内吞适配器)作为阿尔茨海默病(Alzheimer’s disease, AD)的危险因素,能够控制突触表面CP-AMPARs的水平,从而调节体内的LTP和LTD。研究证实,CALM能够选择性地促进泛素化CP-AMPARs的内吞,这种内吞作用通过ANTH结构域来识别而不依赖于网格蛋白。该研究结果表明,CALM和相关包含ANTH结构域的蛋白作为内吞机制的核心决定了突触表面CP-AMPARs水平,以此双向控制大脑的长期突触可塑性并调节学习功能。

核心观点
1、海马神经元中CALM缺失导致突触表面的CP-AMPARs水平升高,使得LTP增加和LTD减少,并改善空间学习能力;
2、神经元CALM通过直接识别GluA1胞质尾端结构域内的决定因素以及泛素化位点的特异性修饰,选择性地促进GluA1同聚体的内吞,从而双向控制长期突触可塑性;
3、CALM的这种活性取决于其直接结合泛素化GluA1以及膜重构以促进胞内囊泡形成的能力;
4、CALM和相关包含ANTH结构域的蛋白HIP1和HIP1R在功能上与CALM重叠,构成了一个内吞平台,能够控制突触表面CP-AMPARs的数量和活性,从而双向调节哺乳动物大脑神经元的长期可塑性。
研究结果分析
1. 突触后内吞蛋白CALM能够拮抗性的控制突触后LTP和LTD,从而调节空间学习能力
在LTD诱导过程中,CP-AMPARs被招募到突触区域,而CI-AMPARs则通过网格蛋白介导的内吞(Clathrin-Mediated Endocytosis, CME)被吞噬回收。在LTD持续的几分钟内,Ca2+浓度的增加激活磷酸酶,诱导GluA1去磷酸化,随后通过一种目前尚不清楚的内吞机制来去除突触表面的CP-AMPAR。
为了确定长时程突触可塑性中CP-AMPARs的内吞机制,作者对分离的小鼠突触小体进行了胰酶消化并筛选,以识别突触后选择性富集的内吞蛋白。在突触小体纯化过程中,突触前部分重新进入一个封闭的隔间,以保护突触前蛋白不被胰酶消化。结果显示,突触前蛋白如Synaptophysin、SNAP-25或Rab3A因受到保护而不被胰酶水解;大多数具有内吞作用的蛋白,包括内啡肽A1、网格蛋白、网格蛋白适配器AP-2和包含BAR结构域的蛋白FCHo2等,同样没被水解,这与已知的突触前富集结果相一致。相比之下,与AD有关的内吞适配器CALM对胰蛋白酶敏感,类似于AMPAR的亚基GluA1和GluA2,以及NMDAR的亚基GluN2A和GluN2B,提示CALM定位于突触后。时间门控STED超分辨显微镜证实了CALM与突触后标志物Homer 1共定位,而在突触前,CALM不太明显。与PSD-95和Homer 1不同,在分离的PSD片段中没有检测到CALM,该片段包含活跃的突触后AMPAR池,这与以下观点一致:可移动的AMPAR的内吞发生于PSD周围的特定胞内区,而不是PSD本身。这些数据表明,CALM是一种内吞蛋白,选择性富集于AMPAR内吞作用发生的突触后区域。
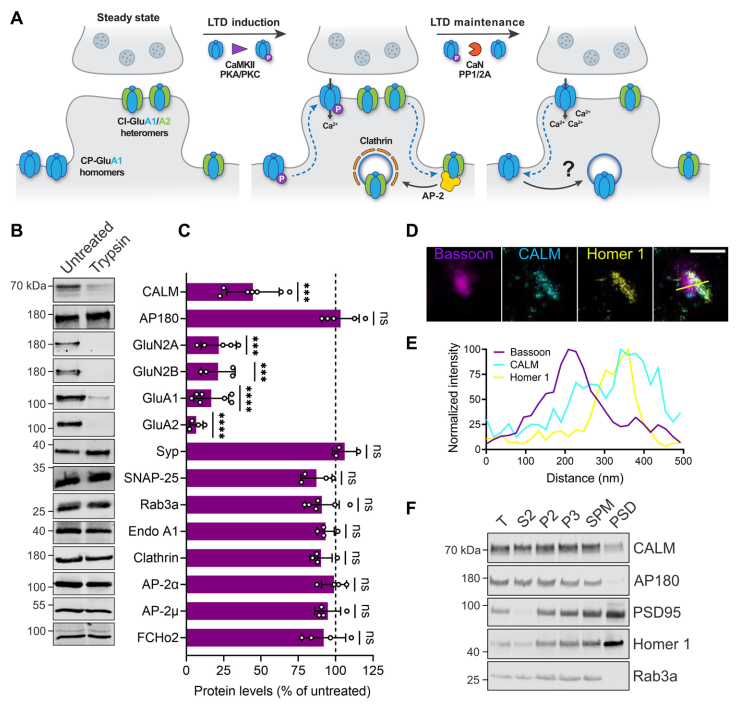
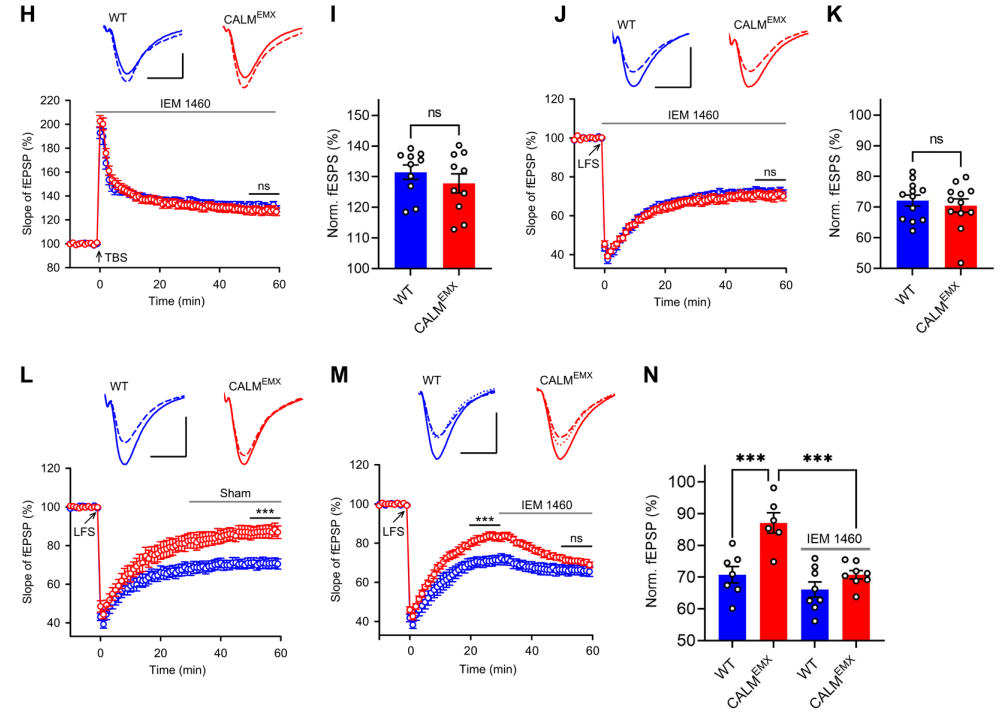
作者假设,CALM可能是在神经传递的长时程可塑性变化过程中,通过亚基选择的方式去除AMPARs的内吞机制的重要组成部分。为了验证这一假设,作者构建了CALM条件性敲除(Knockout,KO)的小鼠,包括,在全脑神经元中缺失的CALMTub小鼠和仅在皮层和海马兴奋性神经元中有表达的CALMEMX小鼠。为了探讨在神经传递的长时程变化中,CALM在AMPARs的内吞清除中所发挥的作用,作者分析了突触后的LTP和LTD。经过单一Theta脉冲刺激(Theta-burst Stimulation,TBS)后,CALMEMX小鼠突触LTP显著增加。相反,2月龄的CALMEMX小鼠由低频刺激(Low-Frequency Stimulation, LFS)诱导的LTD减少,这种减少在2周龄的CALMEMX小鼠中更为明显,这与已知的幼鼠表现出较高的GluA1水平和较强的LTD这一事实相符。因此,CALM能够拮抗性的控制海马突触的突触后LTP和LTD。为了探究所观察到的突触后可塑性变化是否会影响CALM KO小鼠的学习能力,作者进行了Morris水迷宫测试,在训练过程中,CALMEMX小鼠的空间学习能力得到改善。因此,这些结果表明,突触后富集的内吞蛋白CALM能够拮抗性的控制突触LTP和LTD,从而调节海马依赖的空间学习。
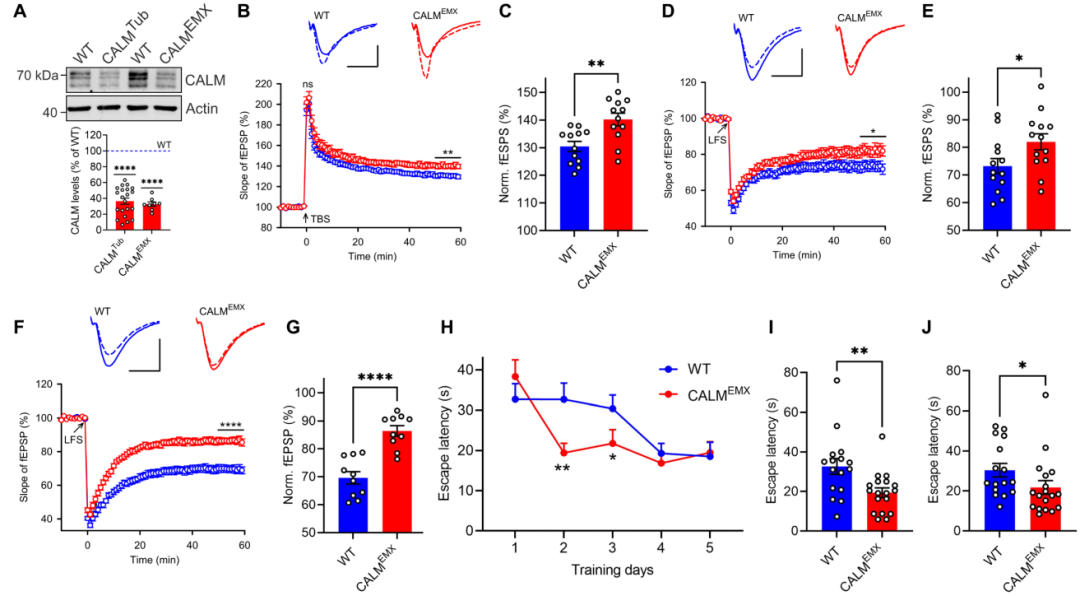
2. CALM缺失导致突触表面CP-AMPARs水平升高,从而促进LTP并损害LTD
作者假设在CALMKO小鼠中所观察到的LTP增加和LTD减少可能是由于突触表面含GluA1和/或GluA2的AMPARs水平改变所致。为了检测GluA1和GluA2的在突触表面的表达水平,作者使用特异性识别GluA1或GluA2细胞外结构域的抗体,对CALMTub小鼠和对照组小鼠的大脑切片进行免疫组化染色,评估GluA1和GluA2的总体水平。结果显示,CALMTub小鼠突触表面GluA1的表达有小幅度但显著的升高,而GluA2表面表达水平未受影响。这些数据表明,神经元CALM的缺失导致部分含GluA1的AMPARs重新分配到神经元表面。
可以想象,这些可能会增加突触中GluA1同源的CP-AMPARs和/或GluA1/2-异聚的CI-AMPARs的蓄集。为了区分这些可能性,作者对培养的器官型切片进行了膜片钳记录,其中突触表面AMPAR的水平可以通过树突上谷氨酸的释放来监测。由于表面定位的GluA1同源的CP-AMPARs在细胞钳制到正电压时对细胞内多胺诱导的外向电流阻断很敏感,导致明显的内向整流,因此可以很容易地将它们与含GluA2的CI-AMPARs区分开来。在CALM缺失的情况下,内向整流指数显著降低。在CALM已被shRNA沉默的野生型小鼠的器官型切片中也观察到了类似的整流指数降低。这些数据表明CALMEMX小鼠突触表面CP-AMPAR的水平升高。CALMEMX器官型切片中过表达CALM不仅挽救了内向整流的减少,而且导致了明显的外向整流,与CP-AMPARs耗尽的结果相一致。这些数据为CALM控制功能性GluA1同聚体的突触表面表达水平提供了证据,并提示在CALMEMX小鼠中,突触表面CP-AMPARs过量是LTP增加和LTD减少的基础。与之一致的是,在诱导后,利用IEM 1460选择性的抑制CP-AMPAR,逆转了CALMEMX小鼠LTP和LTD的改变。仅在LTD后期(如诱导后30分钟)使用IEM 1460也可使CALMEMX切片的LTD恢复到野生型小鼠切片的水平。这些数据支持GluA1同源异构体能够塑造突触可塑性的观点,但在基础突触传递中并不是必要的。总之,这些结果表明,CALM能够控制突触表面CP-AMPARs的水平,从而拮抗性的调节体内突触的长时程可塑性。
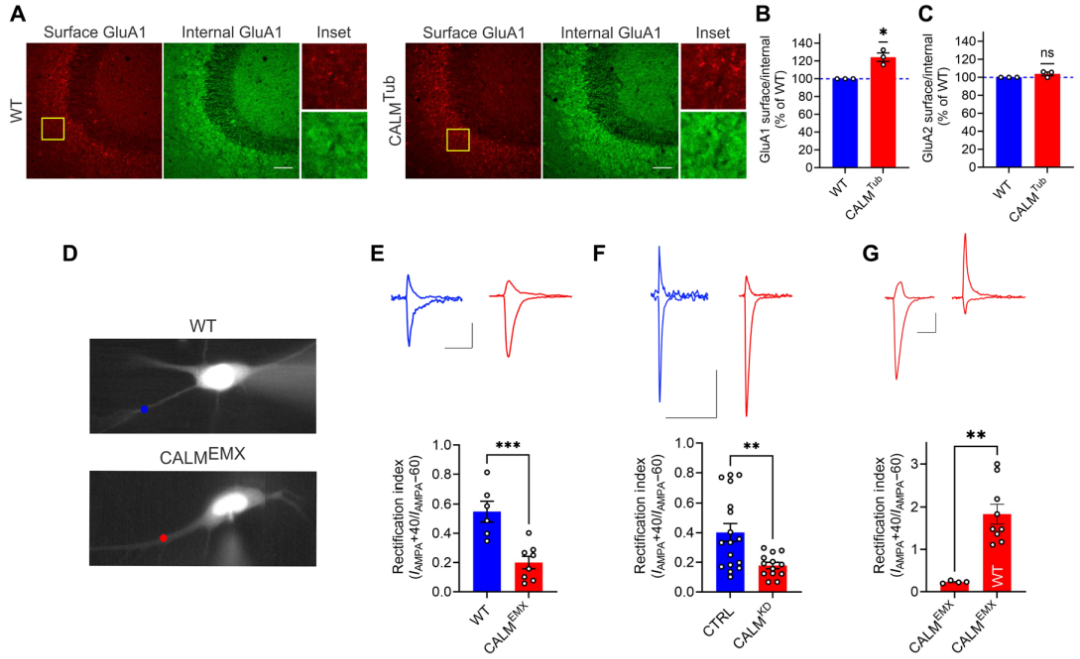
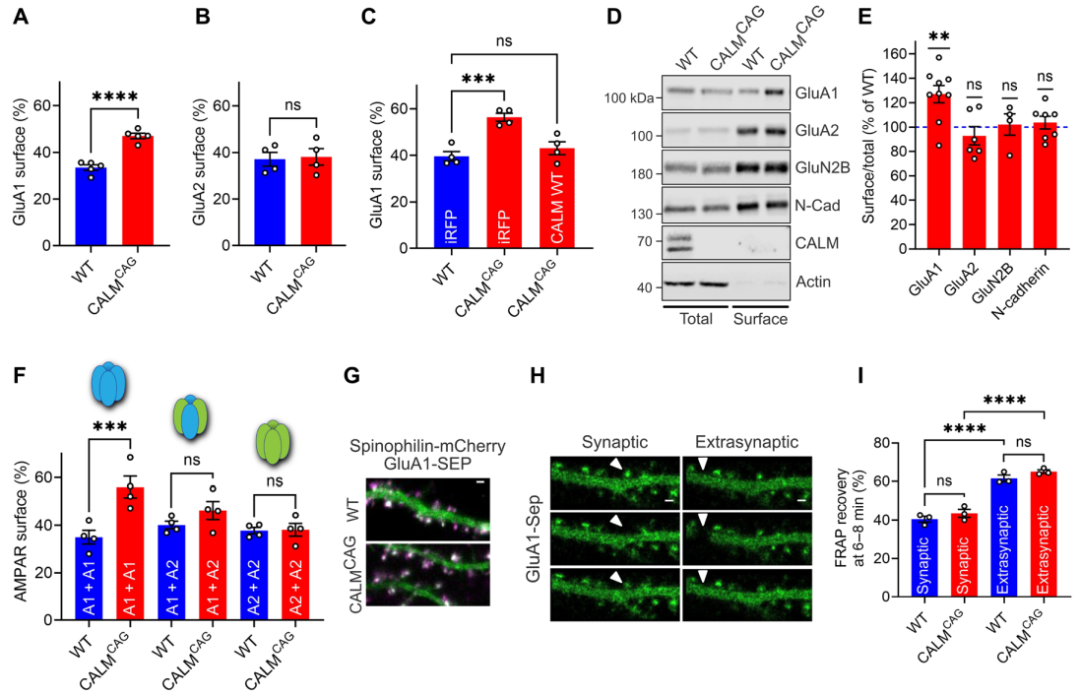
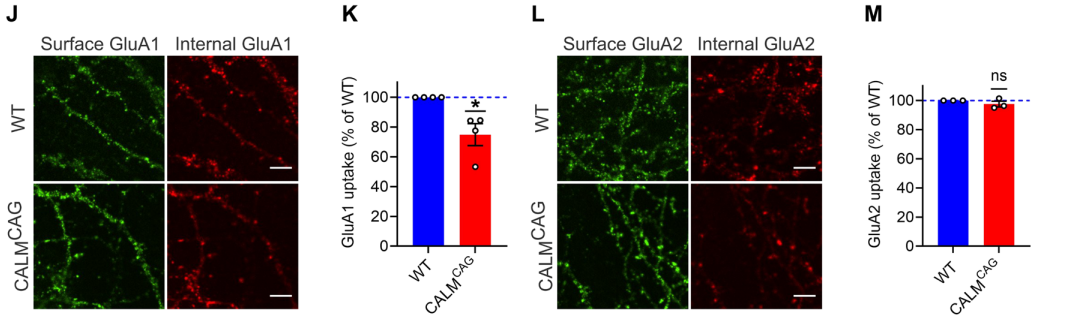
3. 神经元中CALM缺失选择性地损害了海马神经元中GluA1同聚体的内吞
为了搞清楚CALM调节突触可塑性的分子机制,作者构建了它莫西芬可诱导的CALM敲除的小鼠(CALMCAG)。急性它莫西芬诱导的CALMCAG小鼠海马神经元突触表面GluA1的的水平选择性升高,而GluA2的水平保持不变。当使用慢病毒shRNA从WT神经元中清除CALM时,也观察到类似的表型。通过AAV2/9介导全长CALM蛋白重新表达,能够完全拯救GluA1在突触表面的积累。这些数据表明,突触后CALM能够选择性的控制含有GluA1的AMPARs的表面水平。为了找到CALM调节GluA1的直接证据,作者利用生物素标记的方法检测了内源性的GluA1和GluA2在质膜水平。质膜蛋白标记同样证实CALM敲除或敲低的培养神经元中GluA1而非GluA2选择性的突触表面积累。CALM缺失不会影响其他质膜蛋包括GluN2B、NMDAR亚基或N-cadherin的总量或在突触表面的含量。
虽然这些数据表明突触后的CALM能够特异性地控制GluA1在突触表面的水平,但还不能不能明确区分GluA1同聚体和GluA1/2杂聚体在突触表面的积累情况。为了解决这个问题,作者比较了单独表达GluA1或GluA2,或者结合培养形成GluA1/2异聚体的神经元。条件性敲除CALM的导致过表达的GluA1同聚体在突触表面明显积累,并导致GluA1和GluA2联合表达时GluA1/2异聚体表面丰度小幅但不显著的增加。相反,GluA2同聚体的表面池不受CALM缺失的影响。这些结果表明,CALM通过优先识别相对较少的CP-AMPARs群体,即在突触可塑性中发挥关键作用的GluA1同聚体,控制GluA1的表面水平。
可以设想,CALM控制神经元表面GluA1水平的至少有两种不同的机制: 1) CALM可能会调节GluA1的流动性,这是可塑性过程中控制AMPAR功能的关键过程;2) CALM在神经元中可能会特异性的识别GluA1以促进其从突触后膜内吞内化。为了说明CALM在GluA1的胞外插入、募集或扩散中可能发挥的作用,作者进行了FRAP实验(Fluorescence Recovery After Photobleachin, 光漂白后荧光恢复),以确定荧光标记的GluA1在树突棘和树突轴中的流动性。与突触相比,GluA1在突触外区域更活跃,GluA1的FRAP恢复不受CALM缺失的影响。作者进一步使用抗体内化实验监测神经元表面含GluA1或GluA2的内源性AMPARs的内吞。这些结果证实了CALM在神经元中能够选择性地促进CP-AMPARs(即GluA1同聚体)的内吞内化,从而双向调节长期突触可塑性。
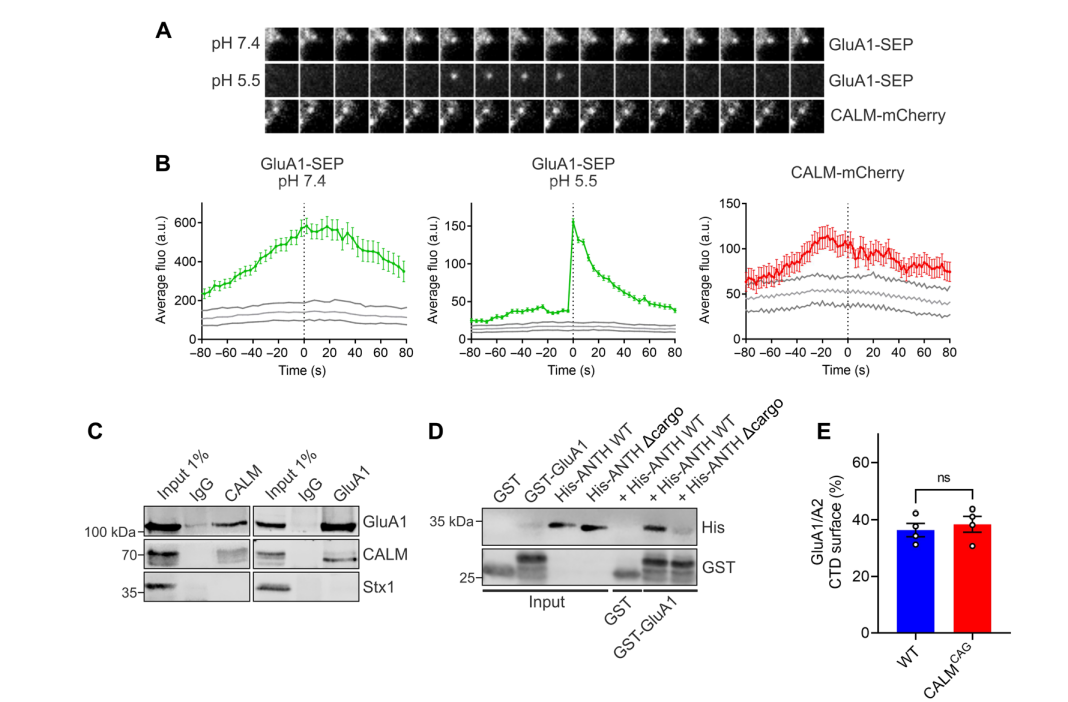
4.GluA1的内吞是由CALM介导的膜重构驱动的,但不依赖于网格蛋白
为了探索CALM介导的GluA1同聚体内吞作用的分子机制,作者利用pH脉冲实验来监测AMPARs内吞事件中CALM的时空动态变化。作者观察到CALM与突触后树突和突触中形成的含有GluA1胞内囊泡存在高时空精度的共定位。表明CALM可能通过直接或间接与GluA1结合,将CP-AMPARs引入内吞位点。为了探究这一点,作者从提取的突触体质膜组分对内源性CALM进行了免疫沉淀,GluA1与CALM共沉淀。这些结果表明,内源性的GluA1和CALM在大脑中形成了复合物。
先前的研究表明,CALM通过所谓的ANTH结构域的不同结合位点与带电的质膜脂类和有内吞作用的蛋白相关联。因此作者推测CALM可能通过其ANTH结构域与GluA1直接相关。为了验证这一点,作者将GST标记了胞质尾端的GluA1与His6标记了ANTH结构域的CALM进行孵育。结果显示CALM-ANTH对GST-GluA1有中度的直接作用,但对GST没有作用。如果已知的ANTH域内结合位点发生突变,复合物的形成就会被破坏。这些结果表明,CALM的ANTH结构域是与GluA1胞质尾端直接关联的充分必要条件。AMPARs可变的C端结构域是赋予不同亚基不同调节模式的位点,与此相一致的是,包含GluA2的C端尾部的GluA1嵌合物未能在CALMCAG神经元的突触表面积累。这些数据表明,CALM通过其ANTH结构域直接关联GluA1的胞质尾端来控制GluA1的表面水平。
鉴于CALM的ANTH结构域在GluA1吞噬过程中的核心作用,作者进一步探索了其功能的分子决定因素。为此,作者构建了多个CALM突变体。然后,利用基于AAV2/9介导野生型或突变体的CALM在CALMCAG中表达,评估它们在CALM缺失后GluA1突触表面积累的拯救能力。野生型的CALM重新表达使GluA1的表面水平恢复到对照组小鼠海马神经元的水平。相比之下,突变体的CALM均无法将GluA1表面积累降低到对照水平。
此外,作者进一步探索了CALM选择性的控制GluA1表面水平是否需要网格蛋白。为此,作者构建了一个缺乏网格蛋白结合的CALM突变体,来确认拯救CALMCAG神经元中GluA1的突触表面积累是否需要与网格蛋白直接关联能力。结果表明,缺乏网格蛋白结合的CALM突变体能够完全拯救GluA1的表面积累。鉴于这一意外发现,作者决定用一种独立的方法来挑战这些结果。作者使用已建立的慢病毒shRNA方法来敲低海马神经元内源性网格蛋白,结果导致网格蛋白水平严重下降到对照组的25-30%。正如预期的那样,网格蛋白的下调严重损害了CME,网格蛋白敲低导致海马神经元中转铁蛋白内吞的能力几乎完全丧失,转铁蛋白的内吞正是依赖CME。网格蛋白敲低神经元的细胞表面转铁蛋白受体水平大约增加了两倍。与其对转铁蛋白摄取的影响相反,网格蛋白减少并不改变神经元表面的GluA1水平。这些数据表明,GluA1的内吞作用是由CALM介导的膜重构驱动的,但不依赖网格蛋白,类似于突触前囊泡蛋白的胞吞作用。
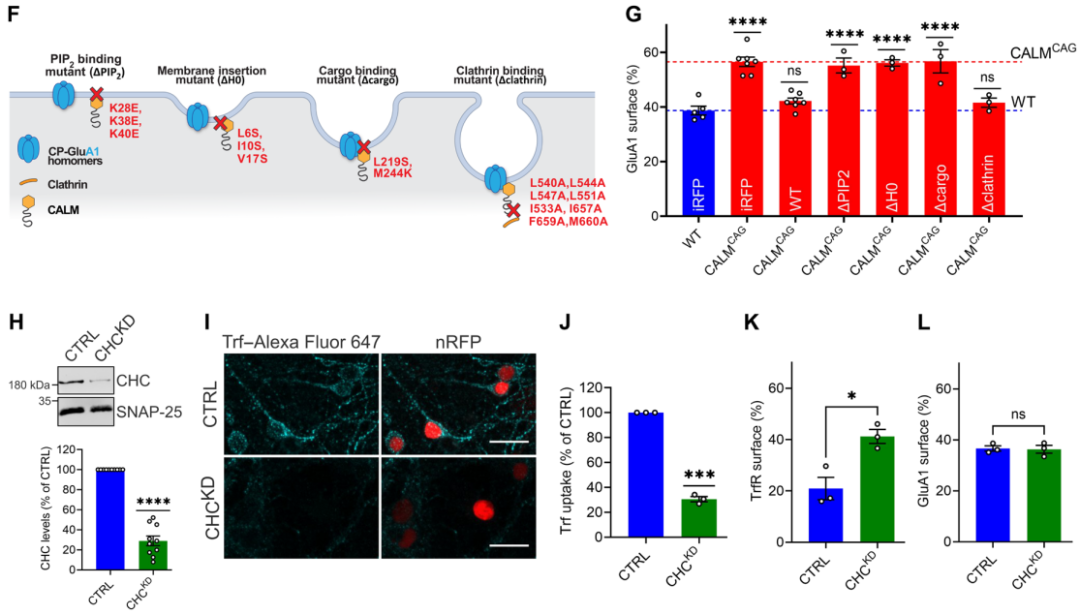
5.CALM和相关包含ANTH结构域的蛋白通过直接识别泛素,促进泛素化的GluA1同聚体内吞
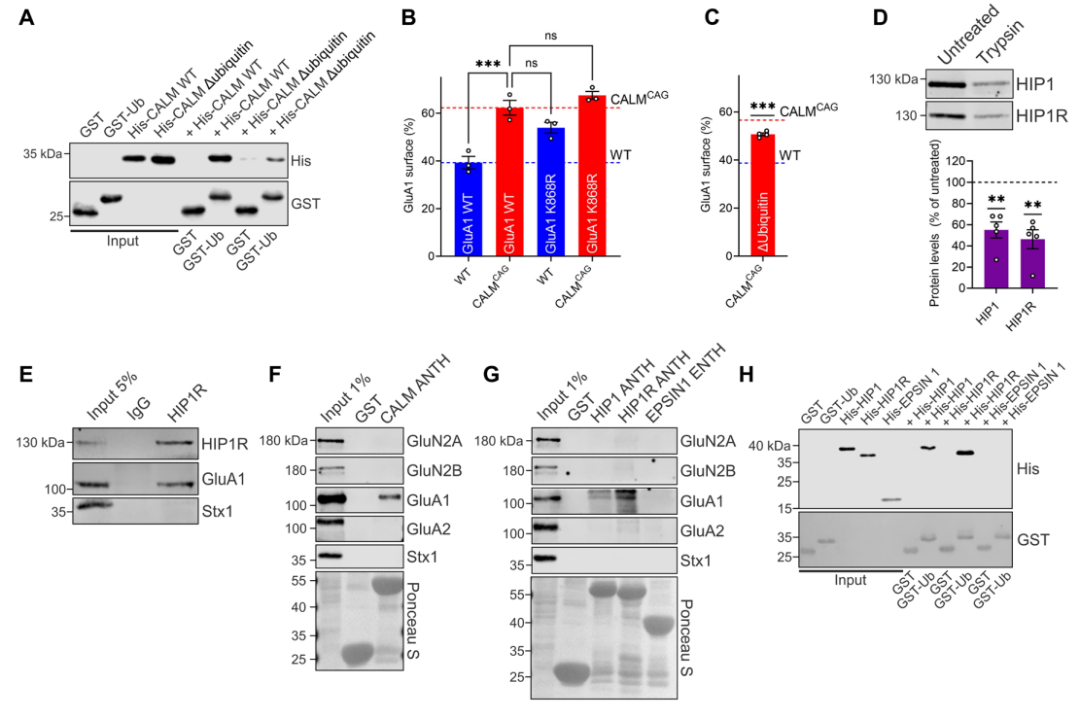
先前的研究表明,在突触活动、稳态缩放、(S)-3,5-二羟基苯甘氨酸诱导的可塑性等过程中GluA1会经历泛素化,促进其内吞噬和/或随后的分选。此外,泛素化已被证明是线虫谷氨酸受体GLR-1的内吞作用的基础,这一过程涉及到CALM/AP180的相关蛋白UNC11,其机制未知。基于这些先前的发现,以及其他非泛素化蛋白与CALM-ANTH结构域的关联较弱的事实,作者假设,CALM介导的GluA1表面水平的控制可能涉及到对GluA1胞质尾端决定因素和对GluA1泛素修饰的同时检测。为了验证了这一假设,作者将全长的CALM和独立的ANTH结构域能够直接结合到GST标记的泛素化微珠上。值得注意的是,干扰GluA1的泛素化会显著增加GluA1的表面积累,在CALMCAG神经元中GluA1泛素化缺失对GluA1的表面积累没有进一步的影响。最后,作者利用核磁共振波谱的结构分析获得的信息,通过定点诱变来失活CALM-ANTH结构域内的泛素化的结合位点。作者分析了泛素结合缺陷的CALM与GST标记的泛素化微珠的结合能力,以及对CALMCAG神经元中GluA1表面积累的拯救能力。泛素结合缺陷的CALM在体外显示出与泛素关联的能力大大降低,并且在将GluA1表面池恢复到对照水平的效率也低得多。这些数据表明,CALM通过直接识别泛素化位点来优先内化泛素化的GluA1同聚体,可能与GluA1胞质尾端包含的其它序列元素结合。
CALM是与HIP1和HIP1R一样的包含ANTH结构域的一小群内吞蛋白的成员,都具有识别泛素化位点的倾向。HIP1先前被认为参与了AMPARs和NMDARs的内吞。因此,作者想探究CALM与相关的包含ANTH结构域的HIP1和HIP1R蛋白在控制GluA1表面水平方面是否有功能重叠。HIP1和HIP1同样位于突触后区域,并在共免疫沉淀实验和亲和层析实验中检测到与内源性GluA1相关联。未检测到GluA1与较远相关的Epsin1-ENTH结构域以及GluA2、GluN2A、GluN2B与各种ANTH结构域之间的相互作用。HIP1和HIP1R的ANTH结构域也与GST标记的泛素化微珠结合。随后,作者探索了HIP1和HIP1R在控制GluA1表面水平可能的重叠作用。通过干扰RNA(siRNA)介导HIP1或HIP1R的敲低,导致与GluA1表面池增加相关的CALM损失。HIP1或HIP1R和CALM的联合缺失进一步加剧了神经元表面GluA1的错配,这表明HIP1和HIP1R在功能上与CALM重叠,可能是平行的。作者通过分析过表达HIP1或HIP1R来拯救CALM缺失来验证这一观点。HIP1或HIP1过表达均显著改善了CALMCAG神经元上GluA1的表面积累。总之,这些发现表明,CALM和相关的包含ANTH结构域的内吞蛋白通过直接识别胞内泛素化的GluA1同聚体来控制GluA1的表面池,从而双向调节突触后可塑性。

总结
该研究结果表明,与泛素结合的突触后胞吞适配器CALM和相关的包含ANTH域的蛋白HIP1和HIP1R作为内吞平台,能够控制GluA1同聚体CP-AMPARs的突触表面水平,拮抗性的控制突触后LTP和LTD,由此调节学习空间。尽管CP-AMPARs只占AMPAR表面池的一小部分,但这些高电导受体的表面积累可以对突触强度产生很大的影响。因此,该研究的结果显著地扩展了AMPAR编码突触可塑性的概念,为GluA1同聚体表面水平的特异性控制提供了分子基础。
亮点研究方法
这项工作阐述了CALM通过控制突触表面CP-AMPARs的水平来双向控制长期突触可塑性的分子机制。研究用到了电生理、免疫组化、原代培养、细胞分子检测以及行为学评估等实验技术。瑞沃德深耕生命科学研究领域20年,一直致力于为客户提供可信赖的解决方案和服务,可提供的该研究中涉及电生理、免疫组化、原代细胞培养、细胞分子检测以及行为学评估等实验的完整解决方案。截至目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球700+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。