星形胶质细胞能够调控有髓鞘轴突的兴奋性和传导速度
星形胶质细胞能够调控有髓鞘轴突的兴奋性和传导速度
文章概述
星形胶质细胞能够支持整个中枢神经系统神经元的功能。在灰质中,它们的作用包括调节发育过程中突触的数量、清除突触释放的神经递质、控制细胞外钾浓度、调节血流、为神经元供能等。在白质中,有髓鞘轴突的结构使得灰质区域之间信息能够快速传递。由于少突胶质细胞几乎将所有的轴突与细胞外空间隔离,因此它们被认为是控制胞外钾离子浓度和向轴突提供能量的主要介质。尽管星形胶质细胞的一些突起发生在郎飞结(Nodes of Ranvier)附近,但星形胶质细胞的作用仍不确定。
有研究提出,学习记忆能力不仅反映了灰质突触功能的变化,还反映了白质功能的变化。尤其是神经环路的功能可能受到白质有髓鞘轴突传导速度变化的调节,这会导致动作电位到达远端神经元的时间发生改变。这种改变可能是由于髓鞘的中间节点或可兴奋的郎飞结的特性改变引起的。
Jonathan Lezmy和David Attwell等人利用免疫组化技术来评估星形胶质细胞如何与有髓鞘的轴突相互作用,利用神经活动和光刺激诱发星形胶质细胞的钙释放,以激发Ca2+依赖的胶质细胞的递质释放,并通过电生理和药理学手段来探讨星形胶质细胞对有髓鞘神经元的轴突起始点(Axon Initial Segment,AIS)和郎飞结的影响。这项研究首次证实并阐明了星形胶质细胞调控白质有髓鞘轴突的兴奋性和传导速度的作用和机制,研究成果于2021年10月15日发表在《Science》杂志上。
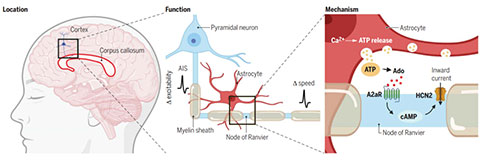
1、星形胶质细胞紧密靠近大脑皮层V层有髓神经元的轴突并进入到胼胝体中。
2、星形胶质细胞内Ca2+的增加能够触发这些细胞释放含 ATP 的囊泡,并引起锥体神经元的AIS和郎飞结中产生内向电流。
3、药理学实验表明,上述过程由腺苷 A2α受体(A2αRs)的激活所介导。星形胶质细胞释放的ATP被细胞外酶转化为腺苷,与A2αRs结合,提高轴突内cAMP 的浓度,从而激活环核苷酸门控离子通道(HCN),介导内向超极化电流,从而使神经元去极化。
4、在 AIS 中,A2αRs的激活会改变局部兴奋性,从而改变动作电位的产生;而在郎飞结中,A2αRs的激活会降低动作电位沿轴突的传导速度。
二、研究结果分析
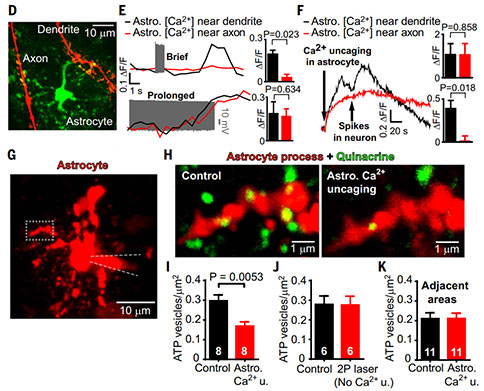
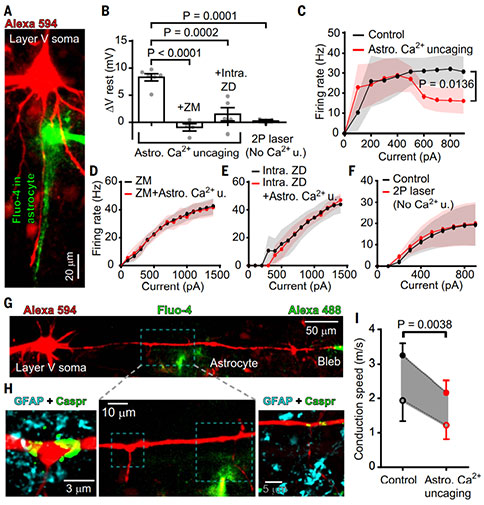
1. 有髓轴突附近的星形胶质细胞胞内Ca2+升高引起ATP释放。
利用星形胶质细胞的标记蛋白(GFAP)对小鼠的皮层进行标记,显示整个灰质和白质中都存在星形胶质细胞。在V层皮质锥体细胞或少突胶质细胞上,星形胶质细胞突起与有髓轴突及其中间节点紧密排列在一起。利用双通道膜片钳技术,向星形胶质细胞加载Ca2+感受染料,同时刺激相邻锥体细胞产生动作电位。当锥体细胞被短暂激活时,星形胶质细胞内靠近神经元树突的突起内Ca2+比靠近神经元轴突的突起内Ca2+升高明显,如果长时间激活锥体神经元,两个位置的突起内Ca2+都会升高。利用光刺激诱导星形胶质细胞内Ca2+释放引起神经元树突和轴突附近突起中的Ca2+同时升高,而相关的神经元活动会导致的树突附近突起内Ca2+进一步上升。
在灰质中,星形胶质细胞可以通过释放三磷酸腺苷(ATP)来调节神经元功能。利用奎纳克林来对 V 层锥体神经元有髓轴突周围星形胶质细胞中含有 ATP 的囊泡进行标记。星形胶质细胞内Ca2+升高引发突起中43% 奎纳克林标记的囊泡丢失,当光刺激不足以引起胞内Ca2+升高时,也没有观察到ATP囊泡的丢失。
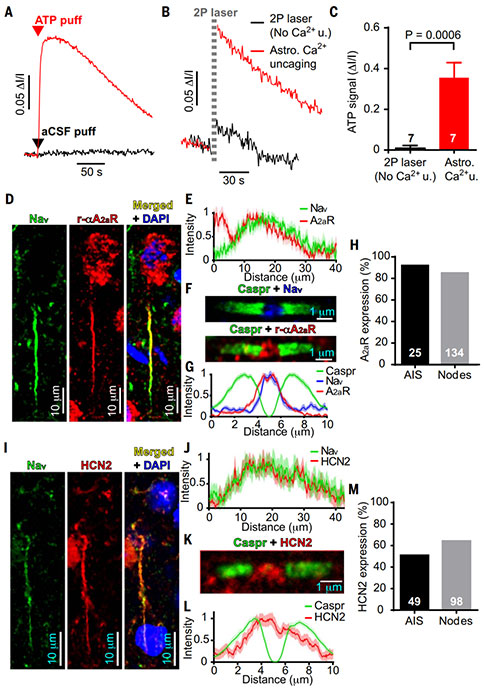
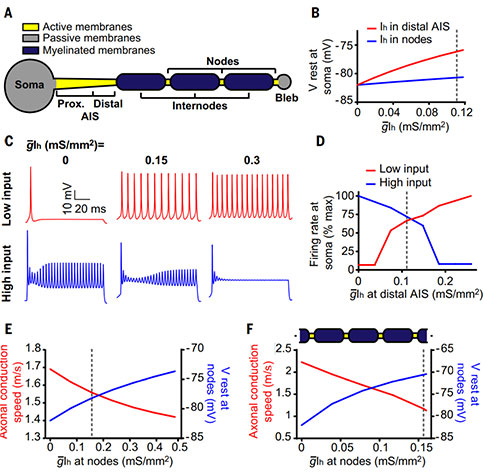
星形胶质细胞内Ca2+升高引起的ATP释放可通过荧光素酶来检测。释放的ATP会被胞外三磷酸腺苷酶迅速水解为腺苷。以前的研究曾报道过在突触中存在腺苷受体。利用免疫组织化学技术对V层神经元有髓鞘轴突上的腺苷受体进行鉴定。92%的AIS和85%的郎飞结中发现了A2αRs。A2αRs可以提高cAMP 水平,促进轴突中超极化活化的HCN离子通道的开放,从而影响细胞的兴奋性。51%的AIS和64%的郎飞结中检测了到 HCN2 通道。
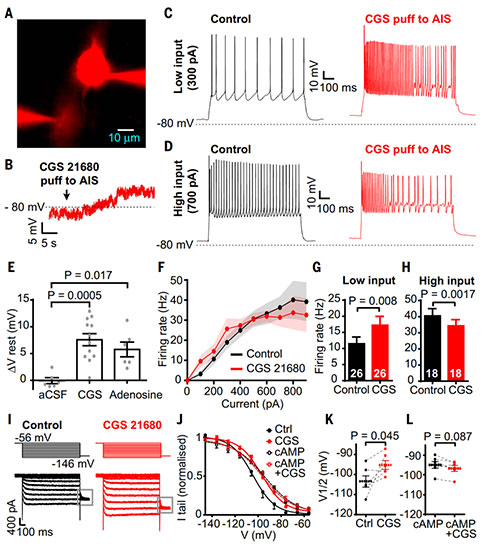
为了确认A2αRs的激活效果,研究者利用膜片钳技术,同时将腺苷和CGS21680(一种A2αRs激动剂)加到AIS附近,这种方式激活A2αRs使膜电位去极化6~7mV。在低电流注入时,激活A2αRs能够增加动作电位频率;在高电流注入时,激活A2αRs反而降低了动作电位的频率,可能是由于增加了Na+通道失活。细胞超极化导致由HCN离子通道介导的时间依赖性内向电流增加,可被ZD7288所阻断。CGS21680增加了内向电流尾电流的幅值,因此更多的内向电流在生理范围内被激活。
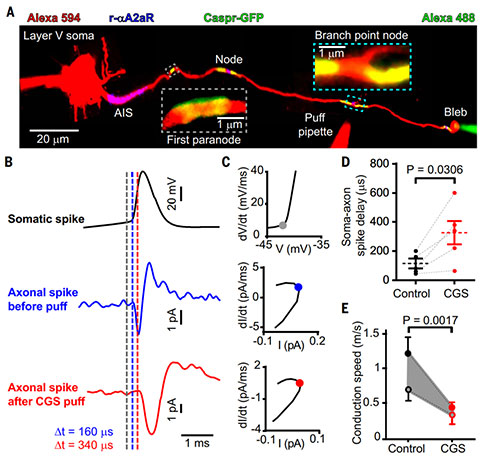
为了评估郎飞结中A2αRs的功能,研究者使用膜片钳对皮层V层锥体细胞进行记录(在距离胞体约3个节点轴突末端膨大处记录)。将电流注入胞体激发动作电位,在轴突末端记录到了延迟的动作电位,向中间的节点给予CGS21680时,末端动作电位变得更加延迟,动作电位在轴突中的传导速度降低。
为了探索A2αRs和内向电流如何影响兴奋性和传导速度,研究者采用胼胝体中有髓轴突的 MATLAB 模型,来模拟连接到胞体的一个有三个节间和一个末端膨大的被截短了的轴突或者是一个无限延长的轴突。AIS和郎飞结中包含电压门控的Na+和K+通道能够产生动作电位,而胞体和末端膨大缺乏这些通道。由于远端AIS中cAMP 激活HCN2通道介导的内向电流增加,因此AIS中由A2αRs激活引起的内向电流增加被建模。
在模型中,将腺苷激活的电导添加到远端AIS引起使胞体去极化,同时增加了低电流注入时的放电频率,减少了高电流注入时的放电频率,并且在模型中,高电流下动作电位幅度下降比实验观察到的要大。将内向电流添加到郎飞结中会降低其传导速度,如上述实验中观察到的一样。模型中降低比实验观察到的要小,可能是因为节点处产生了较小的去极化。采用无限延长的轴突模型,添加腺苷激活的内向电流使节点去极化幅度增加,预测传导速度进一步降低, 并增加轴突动作电位的峰宽度。
星形胶质细胞内Ca2+升高引起 ATP 的释放,推断其将在细胞外转化为腺苷并作用于AIS和郎飞结A2αRs上,研究者进一步测试了星形胶质细胞中Ca2+释放是否调节了皮质V层锥体神经元有髓轴突的兴奋性和传导速度。在刺激星形胶质细胞内Ca2+升高70秒内,神经元的静息电位去极化并且神经元的动作电位发生变化,对低注入电流表现出更高的发放频率和对高注入电流的较低发放频率。这与激活AIS中A2αRs时看到的变化相似,能够被A2αRs和内向电流的阻断剂所阻断。刺激这些有突起靠近郎飞结的些星形胶质细胞胞内Ca2+升高,能够引起轴突传导速度的降低。这与将A2αRs激动剂喷洒到节点上的结果类似。
与灰质一样,星形胶质细胞胞内Ca2+浓度能够调节其ATP在白质细胞外间隙的释放,在ATP转化为腺苷后,可以调节有髓鞘轴突的兴奋性和传导速度。有髓鞘轴突传导速度的改变可能通过改变动作电位到达末梢输出突触的时间来改变神经环路的功能,从而改变突触后神经元的信号整合。星形胶质细胞源性腺苷水平的变化可发生在清醒和睡眠状态之间,细胞外腺苷浓度在能量剥夺条件下上升。这种腺苷水平的改变可以控制白质中信息传递以及神经环路功能。
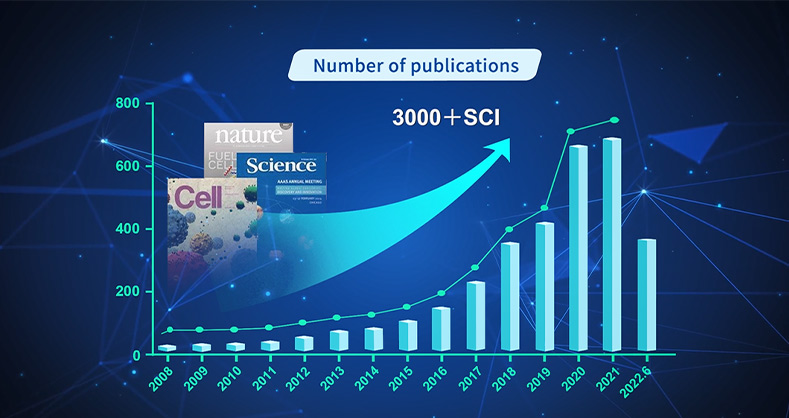
这项工作利用膜片钳、双光子光刺激、免疫组化以及胞外ATP检测等技术,阐述了星形胶质细胞调节有髓鞘轴突的兴奋性和传导速度的作用和机制,取得了突破性的成果。瑞沃德深耕神经科学研究领域近20年,一直致力于为客户提供可信赖的解决方案和服务,可提供这项工作中涉及的电生理、双光子成像、组织病理和分子检测、给药等完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球700+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章12000+,获得行业广泛认可。
星形胶质细胞能够支持整个中枢神经系统神经元的功能。在灰质中,它们的作用包括调节发育过程中突触的数量、清除突触释放的神经递质、控制细胞外钾浓度、调节血流、为神经元供能等。在白质中,有髓鞘轴突的结构使得灰质区域之间信息能够快速传递。由于少突胶质细胞几乎将所有的轴突与细胞外空间隔离,因此它们被认为是控制胞外钾离子浓度和向轴突提供能量的主要介质。尽管星形胶质细胞的一些突起发生在郎飞结(Nodes of Ranvier)附近,但星形胶质细胞的作用仍不确定。
有研究提出,学习记忆能力不仅反映了灰质突触功能的变化,还反映了白质功能的变化。尤其是神经环路的功能可能受到白质有髓鞘轴突传导速度变化的调节,这会导致动作电位到达远端神经元的时间发生改变。这种改变可能是由于髓鞘的中间节点或可兴奋的郎飞结的特性改变引起的。
Jonathan Lezmy和David Attwell等人利用免疫组化技术来评估星形胶质细胞如何与有髓鞘的轴突相互作用,利用神经活动和光刺激诱发星形胶质细胞的钙释放,以激发Ca2+依赖的胶质细胞的递质释放,并通过电生理和药理学手段来探讨星形胶质细胞对有髓鞘神经元的轴突起始点(Axon Initial Segment,AIS)和郎飞结的影响。这项研究首次证实并阐明了星形胶质细胞调控白质有髓鞘轴突的兴奋性和传导速度的作用和机制,研究成果于2021年10月15日发表在《Science》杂志上。

1、星形胶质细胞紧密靠近大脑皮层V层有髓神经元的轴突并进入到胼胝体中。
2、星形胶质细胞内Ca2+的增加能够触发这些细胞释放含 ATP 的囊泡,并引起锥体神经元的AIS和郎飞结中产生内向电流。
3、药理学实验表明,上述过程由腺苷 A2α受体(A2αRs)的激活所介导。星形胶质细胞释放的ATP被细胞外酶转化为腺苷,与A2αRs结合,提高轴突内cAMP 的浓度,从而激活环核苷酸门控离子通道(HCN),介导内向超极化电流,从而使神经元去极化。
4、在 AIS 中,A2αRs的激活会改变局部兴奋性,从而改变动作电位的产生;而在郎飞结中,A2αRs的激活会降低动作电位沿轴突的传导速度。
二、研究结果分析
1. 有髓轴突附近的星形胶质细胞胞内Ca2+升高引起ATP释放。
利用星形胶质细胞的标记蛋白(GFAP)对小鼠的皮层进行标记,显示整个灰质和白质中都存在星形胶质细胞。在V层皮质锥体细胞或少突胶质细胞上,星形胶质细胞突起与有髓轴突及其中间节点紧密排列在一起。利用双通道膜片钳技术,向星形胶质细胞加载Ca2+感受染料,同时刺激相邻锥体细胞产生动作电位。当锥体细胞被短暂激活时,星形胶质细胞内靠近神经元树突的突起内Ca2+比靠近神经元轴突的突起内Ca2+升高明显,如果长时间激活锥体神经元,两个位置的突起内Ca2+都会升高。利用光刺激诱导星形胶质细胞内Ca2+释放引起神经元树突和轴突附近突起中的Ca2+同时升高,而相关的神经元活动会导致的树突附近突起内Ca2+进一步上升。
在灰质中,星形胶质细胞可以通过释放三磷酸腺苷(ATP)来调节神经元功能。利用奎纳克林来对 V 层锥体神经元有髓轴突周围星形胶质细胞中含有 ATP 的囊泡进行标记。星形胶质细胞内Ca2+升高引发突起中43% 奎纳克林标记的囊泡丢失,当光刺激不足以引起胞内Ca2+升高时,也没有观察到ATP囊泡的丢失。
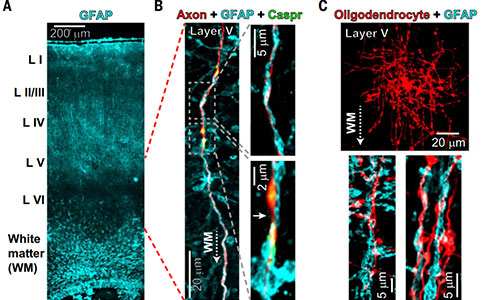
星形胶质细胞内Ca2+升高引起的ATP释放可通过荧光素酶来检测。释放的ATP会被胞外三磷酸腺苷酶迅速水解为腺苷。以前的研究曾报道过在突触中存在腺苷受体。利用免疫组织化学技术对V层神经元有髓鞘轴突上的腺苷受体进行鉴定。92%的AIS和85%的郎飞结中发现了A2αRs。A2αRs可以提高cAMP 水平,促进轴突中超极化活化的HCN离子通道的开放,从而影响细胞的兴奋性。51%的AIS和64%的郎飞结中检测了到 HCN2 通道。
为了确认A2αRs的激活效果,研究者利用膜片钳技术,同时将腺苷和CGS21680(一种A2αRs激动剂)加到AIS附近,这种方式激活A2αRs使膜电位去极化6~7mV。在低电流注入时,激活A2αRs能够增加动作电位频率;在高电流注入时,激活A2αRs反而降低了动作电位的频率,可能是由于增加了Na+通道失活。细胞超极化导致由HCN离子通道介导的时间依赖性内向电流增加,可被ZD7288所阻断。CGS21680增加了内向电流尾电流的幅值,因此更多的内向电流在生理范围内被激活。
为了评估郎飞结中A2αRs的功能,研究者使用膜片钳对皮层V层锥体细胞进行记录(在距离胞体约3个节点轴突末端膨大处记录)。将电流注入胞体激发动作电位,在轴突末端记录到了延迟的动作电位,向中间的节点给予CGS21680时,末端动作电位变得更加延迟,动作电位在轴突中的传导速度降低。
为了探索A2αRs和内向电流如何影响兴奋性和传导速度,研究者采用胼胝体中有髓轴突的 MATLAB 模型,来模拟连接到胞体的一个有三个节间和一个末端膨大的被截短了的轴突或者是一个无限延长的轴突。AIS和郎飞结中包含电压门控的Na+和K+通道能够产生动作电位,而胞体和末端膨大缺乏这些通道。由于远端AIS中cAMP 激活HCN2通道介导的内向电流增加,因此AIS中由A2αRs激活引起的内向电流增加被建模。
在模型中,将腺苷激活的电导添加到远端AIS引起使胞体去极化,同时增加了低电流注入时的放电频率,减少了高电流注入时的放电频率,并且在模型中,高电流下动作电位幅度下降比实验观察到的要大。将内向电流添加到郎飞结中会降低其传导速度,如上述实验中观察到的一样。模型中降低比实验观察到的要小,可能是因为节点处产生了较小的去极化。采用无限延长的轴突模型,添加腺苷激活的内向电流使节点去极化幅度增加,预测传导速度进一步降低, 并增加轴突动作电位的峰宽度。
星形胶质细胞内Ca2+升高引起 ATP 的释放,推断其将在细胞外转化为腺苷并作用于AIS和郎飞结A2αRs上,研究者进一步测试了星形胶质细胞中Ca2+释放是否调节了皮质V层锥体神经元有髓轴突的兴奋性和传导速度。在刺激星形胶质细胞内Ca2+升高70秒内,神经元的静息电位去极化并且神经元的动作电位发生变化,对低注入电流表现出更高的发放频率和对高注入电流的较低发放频率。这与激活AIS中A2αRs时看到的变化相似,能够被A2αRs和内向电流的阻断剂所阻断。刺激这些有突起靠近郎飞结的些星形胶质细胞胞内Ca2+升高,能够引起轴突传导速度的降低。这与将A2αRs激动剂喷洒到节点上的结果类似。
与灰质一样,星形胶质细胞胞内Ca2+浓度能够调节其ATP在白质细胞外间隙的释放,在ATP转化为腺苷后,可以调节有髓鞘轴突的兴奋性和传导速度。有髓鞘轴突传导速度的改变可能通过改变动作电位到达末梢输出突触的时间来改变神经环路的功能,从而改变突触后神经元的信号整合。星形胶质细胞源性腺苷水平的变化可发生在清醒和睡眠状态之间,细胞外腺苷浓度在能量剥夺条件下上升。这种腺苷水平的改变可以控制白质中信息传递以及神经环路功能。
这项工作利用膜片钳、双光子光刺激、免疫组化以及胞外ATP检测等技术,阐述了星形胶质细胞调节有髓鞘轴突的兴奋性和传导速度的作用和机制,取得了突破性的成果。瑞沃德深耕神经科学研究领域近20年,一直致力于为客户提供可信赖的解决方案和服务,可提供这项工作中涉及的电生理、双光子成像、组织病理和分子检测、给药等完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球700+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章12000+,获得行业广泛认可。
相关推荐
评论列表共有 0 条评论
暂无评论
发表评论
取消回复