Current Biology:依赖内侧隔核H2R信号的组胺能环路能够调控进食行为
文章概述
在世界范围内,肥胖是一个日益严重的健康问题,非典型的高热量摄入是肥胖和其它继发性疾病的主要原因。目前肥胖干预的一些手段,包括行为疗法、减肥手术、药物治疗等,均未达到理想的效果。控制食物摄入是减肥人群常用的手段之一,但是由于摄食行为的调节机制目前尚未完全明确,无法有针对性的进行调控,因此在减肥中的效果同样不佳。摄食行为非常复杂,受多个特定的中枢神经环路控制。组胺长期以来被认为是一种厌食剂,组胺能(Histaminergic,HA)系统被认为与摄食行为有关,其主要通过激活组胺1型受体(Histamine 1 Receptor, H1R)来实现其功能,然而,对于特定的HA进食环路机制目前我们仍不清楚。
2022年3月25日,浙江大学药学院陈忠教授团队在《Current Biology》发表题为“An H2R-dependent medial septum histaminergic circuit mediates feeding behavior”的研究论文。该研究利用光纤记录、光遗传学、化学遗传学以及药理学等手段揭示了一个起源于结节乳头体(Tuberomammilary Nucleus, TMN)投射到内侧隔核(Medial Septum, MS)的进食控制环路,该环路通过下游MS中的谷氨酸能(Glutamatergic/Glu)神经元上的组胺2型受体(Histamine 2 Receptor, H2R)对动物的摄食行为进行调节。文章结果为肥胖以及相关的疾病的治疗提供了一个极具潜力的治疗靶点。

核心观点
1、TMNHA—MS环路能够双向调节进食行为;
2、MSGlu神经元上的H2R信号介导了组胺所致的厌食作用;
3、肥胖小鼠MSGlu神经元上H2R的表达呈病理性降低;
4、调控MSGlu神经元上H2R的功能能够调节体重。
研究结果分析
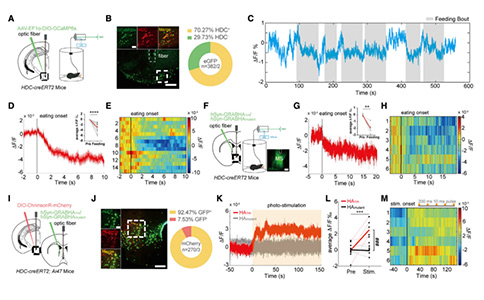
1. 在进食过程中,MS组胺能神经元及其传入神经活动受到抑制
为了验证HA神经元是否参与了摄食过程,研究者通过将AAV-Ef1a-DIO-GCaMP6s病毒注射到HDC-CreERT2(组氨酸脱羧酶,Histidine Decarboxylase/HDC)小鼠的TMN中,以此在HA神经元上特异性表达GCaMP6s,并利用光纤记录系统来记录这些神经元的活动。禁食24小时的小鼠在进食过程中TMN神经元的活动减少。为了研究TMNHA—MS环路是否参与了摄食行为,研究者将组胺分子探针病毒AAV9-hSyn-GRABHA1m注射到MS中,并在MS上方植入光纤来记录分子探针的荧光变化(当与组胺结合时,该分子探针在473nm蓝光激发下显示荧光,因此可用于报告局部组胺浓度的波动)。当小鼠开始进食时,探针的荧光信号减少,表明MS中组胺分子释放与进食行为有关。此外,为了验证TMN—MS之间存在HA功能连接,研究者利用光遗传技术激活小鼠TMN中的HA神经元,同时利用光纤记录系统监测下游MS中组胺水平的变化。结果显示,当TMN中HA神经元被激活时,MS中组胺水平随之升高。
这些结果表明,TMNHA—MS环路参与了进食行为,并且MS中的HA投射在进食阶段被抑制。
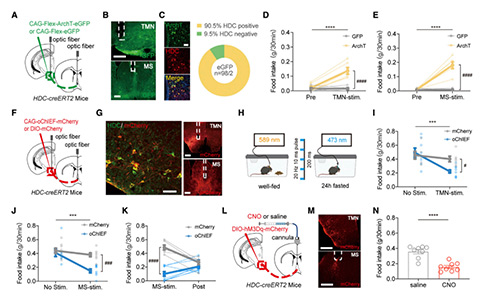
2. 在进食过程中,MS组胺能神经元及其传入神经活动受到抑制
为了测试抑制TMN—MS的HA环路是否能够驱动进食,研究者将AAV-CAG-Flex-ArchT-GFP病毒注射到HDC-CreERT2小鼠的TMN中,并在TMN和MS上方植入光纤。在随后的测试中, 已经喂养良好的小鼠,其TMNHA神经元和TMNHA神经元投射末梢(MS中)受到光照抑制时,仍能促进动物进食;而在不给予光刺激时或者对照小鼠中,均未观察进食增加。这些数据表明,抑制TMN—MS HA环路能够驱动进食。
接下来,作者研究了激活该环路是否可以抑制进食行为。作者将AAV-DIO-oChIEF-tDTomato注射到HDC-CreERT2小鼠的TMN中,并在TMN和MS上方植入光纤。结果显示,激活TMNHA—MS环路可以减少禁食24小时小鼠的食物摄入量。为了确定TMNHA神经元与进食行为的因果关系和时间作用,研究者对视频分析发现,小鼠通常会在光刺激开始时停止喂食或减少喂食时间。此外,禁食小鼠在光刺激停止时段立即恢复了正常的食物摄入量。随后,研究者将AAV-Ef1a-DIO-hM3Dq- mCherry注射到的HDC-CreERT2小鼠的TMN区域,利用化学遗传学来进一步确认这一结果。同样,与对照组相比,在表达hM3Dq的MS HA末端局部给予CNO减少了禁食小鼠的食物摄入量。
这些结果表明,TMNHA—MS环路能够双向调节进食行为。
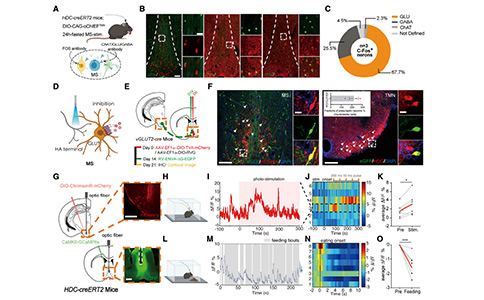
3. MSGlu神经元是TMNHA—MS进食抑制环路的主要组成部分
由于MS中的胆碱能(Cholinergic/ChAT)、氨基丁酸能(GABAergic/GABA)和Glu神经元均被报道与进食行为有关,因此作者试图验证与该HA进食抑制环路有关的神经亚群。在光遗传激活TMNHA—MS环路后,研究者首先检测了MS中这三类神经元的激活情况(c-Fos表达)。结果显示,MS中大部分c-Fos阳性细胞为Glu神经元(67.7%),少数为GABA神经元(25.5%),极少数为ChAT神经元(2.3%),提示MSGlu神经元可能是TMN—MS HA进食抑制环路的主要下游成分。为了确认MSGlu神经元是接收TMNHA神经元投射的主要目标,研究者利用逆行示踪病毒特异性感染了MSGlu神经元,并在TMN中HA神经元检测到了荧光表达,证实了TMNHA神经元向MSGlu神经元发出单突触神经投射。
为了验证MSGlu神经元活动是由TMNHA神经元所调控,研究者利用光遗传技术激活TMNHA神经元,同时利用光纤记录技术分析MSGlu神经元的钙活动。通过光遗传激活TMNHA神经元时,同时观察到MSGlu神经元活动增加。结合逆行示踪结果,证实了TMNHA神经元和MSGlu神经元之间的解剖学和生理学联系。
为了进一步阐明MSGlu神经元在TMNHA—MS进食抑制环路中的作用,研究者分析了MSGlu神经元在进食行为中的作用。通过记录MSGlu神经元在进食过程中的钙活动,观察到MSGlu神经元活动在食物摄入后迅速从高到低转换,并在停止进食时升高。研究者还进行了一个长期实验,利用化学遗传学来抑制MSGlu神经元。与对照组相比,长期抑制MSGlu神经元有效的诱导了小鼠的体重增加。这些结果表明MSGlu神经元可能是治疗肥胖的潜在靶点。
此外,为了检测在TMNHA—MS环路中是否需要通过激活MSGlu神经元来抑制进食,研究者还设计了一个结合化学遗传学和光遗传学技术的实验,通过将AAV-CAG-oChIEF-mCherry病毒注射到TMN区域,将AAV-CaMKIIa-hM4d-eGFP病毒注射到MS中,并且在MS上方植入套管。禁食24小时的小鼠,在给予光刺激激活TMNHA—MS进食抑制环路的前15分钟微量注入CNO,如预期所料,利用化学遗传学抑制MSGlu神经元挽救了TMNHA—MS环路激活所引起的进食抑制,表明MSGlu神经元可能是HA进食抑制环路的主要下游成分。
考虑到刺激TMNHA—MS环路后也有少数GABA神经元被激活,研究者同样测试了这些神经元在TMNHA—MS环路中的作用。实验观察到,MSGABA神经元对MS中HA末梢的激活没有反应。此外,利用化学遗传学对MSGABA神经元抑制并不能挽救TMNHA—MS环路激活引起的进食抑制。综上所述,TMNHA—MS环路通过下游MSGlu神经元来实现其进食抑制的作用。
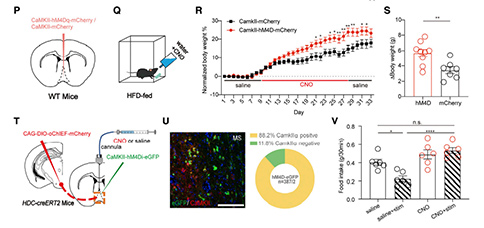
4. TMNHA—MS环路通过MSGlu神经元上的H2R信号调控进食
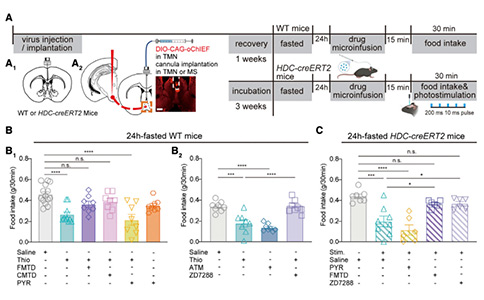
作者进一步研究了组胺受体作为潜在靶点在进食抑制环路中的作用。研究者在小鼠的MS中植入给药导管,并给予硫丙咪胺(一种H3R拮抗剂,可提高局部组胺浓度),观察到禁食24小时小鼠的食物摄入量减少,该实验模拟了TMNHA—MS激活引起的厌食效应。
以往的研究表明,肥胖更可能与H1R有关,而不是H2R。研究者首先测试H1R在该HA环路中的功能。令人惊讶的是,嘧啶胺(一种H1R拮抗剂)与硫丙咪胺联合使用并没有消除HA环路的进食抑制作用,单独使用嘧啶胺对食物摄入没有强烈影响。然后研究者在MS中注入H2R拮抗剂(法莫替丁或西咪替丁,与硫丙咪胺联合使用),并测量禁食24小时小鼠的基本食物摄入量,法莫替丁和西咪替丁都能显著改善硫丙咪胺对进食的抑制作用。为了进一步确定中MS中H2R在摄食中的作用,研究者还使用了Amthamine(H2R激动剂)直接激活下游H2R,再次观察到食物摄入量的下降,这比硫丙咪胺的作用略强,表明H2R在该进食抑制环路中起着关键作用。
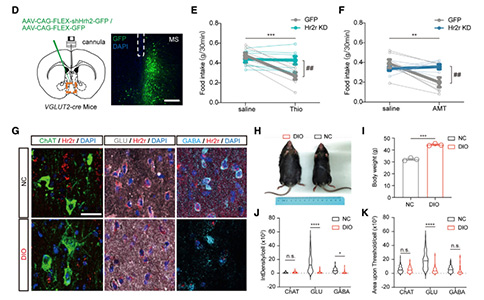
然而,当研究者用ZD7288(HCN通道选择性阻断剂)阻断H2R下游超极化激活环核苷酸门控(HCN)通道时,进食抑制效应消失,进一步表明H2R在进食抑制性TMNHA—MS环路中的重要作用。此外,研究者结合了药理学和光遗传学方法,将AAV-CAG-DIO-oChIEF-mCherry注入HDC-CreERT2小鼠的TMN区域,并在MS上方植入套管,在TMNHA—MS环路激活前15分钟预先给予法莫替丁或ZD7288,其进食抑制效应基本消失。为了明确研究MSGlu神经元上H2R在该HA环路中的作用,研究者利用shRNA,在MS中条件性的敲除了H2R,硫丙咪胺或Amthamine诱导的进食抑制效应都减弱了,证明了H2R在该环路中关键作用。综上所述,TMNHA—MS环路通过MSGlu神经元的H2R信号介导厌食效应。
为了揭示MS中H2R的数量和分布是否存在生理和病理差异,研究者检测了饮食诱导的肥胖小鼠MS中H2R的表达情况,结果显示,H2R的数量在MSGlu神经元中选择性的减少。这些结果表明,MS中的H2R是TMNHA—MS厌食环路中的重要靶点,并且H2R在肥胖小鼠的MS中存在病理改变,尤其是在Glu神经元中。这些数据促使研究者进一步评估MS中的H2R是否能够反过来调节食物的摄入或者体重异常。
5. 调控MSGlu神经元上H2R的功能可以调节小鼠体重
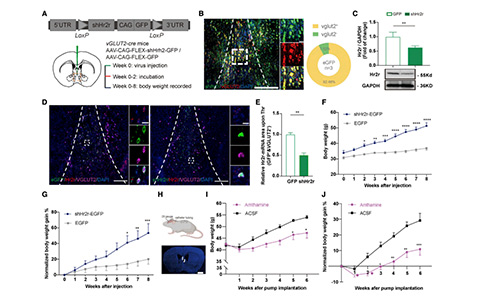
为了确定H2R用于治疗肥胖相关疾病的可能性,研究者利用AAV病毒条件性敲除MSGlu神经元中的H2R。8周的体重分析显示,与同窝小鼠相比,敲除H2R显著加速了高脂饮食小鼠的体重增加,其体重差异与时间呈正相关。这表明MS中的H2R能够调节高脂饮食诱导的肥胖。
为了证明H2R激动剂在临床肥胖治疗的应用潜力,研究者通过皮下植入缓释泵的方式向肥胖小鼠的MS中连续给予H2R的激动剂Amthamine 42天。与对照组相比,长期给予Amthamine可显著降低肥胖小鼠的体重增加。这些结果表明H2R不仅影响小鼠脂肪的形成,而且还能促进肥胖小鼠减肥。
综上所述,MSGlu神经元中的H2R能够双向调节体重,有望成为治疗肥胖或过度喂养相关疾病的新策略。
总结
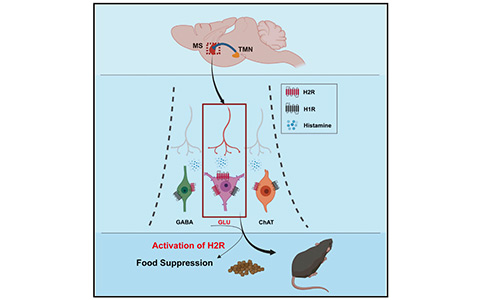
本研究揭示了一个新型的TMNHA—MS环路,该环路可以双向调节食物摄入:选择性抑制TMNHA—MS环路能够驱动进食,而激活该环路可以抑制进食。该环路双向调控进食行为依赖MSGlu神经元中的H2R信号发挥作用:下调MSGlu神经元中H2R的表达会加速体重增加,而慢性激活MSGlu神经元中的H2R 能够显著减缓肥胖小鼠的体重增加。总之,该研究的结果表明,TMNHA—MS环路在进食中起关键作用,MSGlu神经元中的H2R则是治疗肥胖的一个潜在靶点。
亮点研究方法













