文献速读 | 缺血性脑卒中研究进展
Science Advances:揭示脑缺血后小胶质细胞调控神经元突触丢失的作用机制
中枢神经系统缺血的治疗方法集中于引起缺血损伤的机制,即神经兴奋性毒性。不幸的是,到目前为止,针对谷氨酸受体、γ-氨基丁酸(GABA)受体、钙离子通道、钠离子通道和自由基进行治疗的临床试验均以失败告终。由于我们的大脑已经发展出良好的自我保护的机制,因此深入了解这些保护机制可能会为对抗缺血性脑损伤提供一种途径。小胶质细胞是中枢神经系统中的常驻免疫细胞,大脑急性损伤可触发小胶质细胞激活,从而产生防御保护作用,但是其中的作用机制尚不完全清楚。
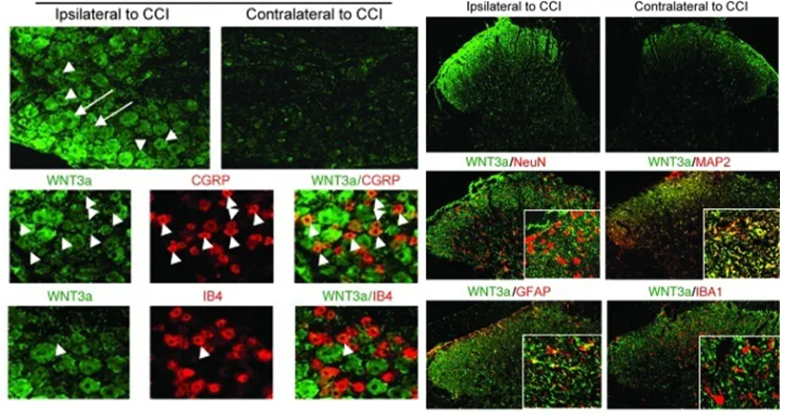
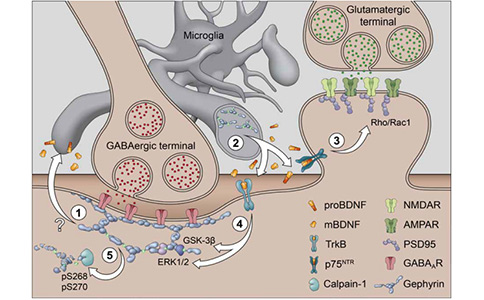
2022年3月4日,瑞士苏黎世大学的研究人员在《Science Advances》期刊上发表题为“Cross-talk between GABAergic postsynapse and microglia regulate synapse loss after brain ischemia”的文章。该研究证实,在体外培养的海马体切片中以及短暂的大脑中动脉闭塞(Middle Cerebral Artery Occlusion, MCAO)小鼠体内,在缺血24小时后,小胶质细胞释放的脑源性神经营养因子(Brain-Derived Neurotrophic Factor, BDNF)能够下调梗死周围的谷氨酸能和GABA能突触。海马角1(Cornu Ammonis 1, CA1)中的BDNF前体(proBDNF)和成熟体(mBDNF)分别通过p75神经营养因子受体(p75 Neurotrophin Receptor, p75NTR)和原肌球蛋白受体激酶B受体(Tropomyosin Receptor Kinase B, TrkB)来下调谷氨酸能树突棘和桥尾支架的稳定性。此外,在MCAO后,体内梗死周围区域和相应的对侧半球同样出现由小胶质细胞激活和桥尾蛋白磷酸化所致类似的突触重塑。选择性的缺失小胶质细胞中的Bdnf或者点突变GphnS268A/S270A(表现为磷酸化缺失)可以防止MCAO后的缺血性脑损伤、神经炎症和突触丢失。
这些结果揭示了来源于小胶质细胞的BDNF作为连接小胶质细胞和神经元的信号转换器,能够激活ERK1/2和GSK3通路,通过桥尾蛋白磷酸化来影响谷氨酸能和GABA能突触的完整性。
JCI:阐述中性粒细胞胞外诱捕网调节缺血性脑卒中的作用机制
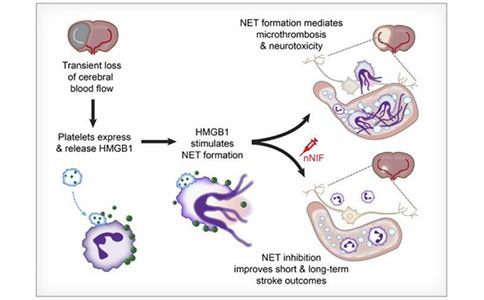
缺血性脑损伤引发强烈的炎症反应,与其不良的预后有关。大量研究表明,一旦脑血流停止,大脑内就会发生有害的炎症级联反应、微血管血栓形成和神经毒性,无论再灌注治疗与否,都会导致缺血性中风的结局。
2022年3月31日,犹他大学的研究人员在《Journal of Clinical Investigation》期刊上发表了一篇题为“Neutrophil Extracellular Traps Regulate Ischemic Stroke Brain Injury”的研究论文,该研究探讨了诱导中性粒细胞胞外诱捕网(Neutrophil Extracellular Trap, NET)形成的调控因子,以及它们是否与卒中结局有关。研究结果显示,NET相关的中性粒细胞遍布缺血性脑卒中患者的脑组织中,并且血浆NET升高与卒中后较差的预后有关。此外,卒中患者血浆中和血小板表面高迁移率族蛋白B1(High Mobility Group Box 1, HMGB1)表达增加。血小板被确定为在卒中急性期引起NETs的HMGB1的关键来源。消耗血小板或特异性敲除血小板中的HMGB1可显著降低卒中后血浆中HMGB1和NET的水平,并大大改善卒中结局。
随后作者进一步探讨了新生NET抑制因子(neonatal NET Inhibitory Factor, nNIF)对缺血性脑卒中的治疗潜力。用nNIF治疗的小鼠脑梗死较小,并且长期的神经和运动功能得到改善,中风后的存活率更高。nNIF能够特异性的阻断脑卒中后NET的形成而不影响中性粒细胞的募集。重要的是,nNIF也改善了糖尿病和老年小鼠的中风结局,并且在中风发作1 h后仍然有效。
这些结果揭示了NETs在缺血性脑中风中的病理作用,为进一步研究nNIF在缺血性脑中风治疗中的作用提供了依据。
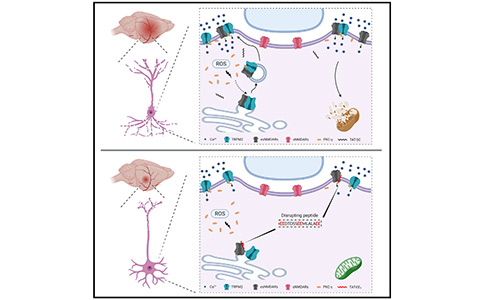
Neuron:TRPM2和突触外NMDA受体的功能耦合加重了缺血性脑卒中的神经兴奋性毒性
缺血性脑卒中是全球致残和死亡的主要原因。NMDA受体(NMDAR)激活引起的神经兴奋性毒性在缺血性脑卒中神经元死亡中起了关键作用。然而,临床上直接针对NMDARs的治疗却以失败告终。
2022年4月13日,康涅狄格大学医学院的研究人员在《Neuron》期刊上发表了一篇题为“Functional coupling of TRPM2 and extrasynaptic NMDARs exacerbates excitotoxicity in ischemic brain injury”的研究论文。该研究揭示了NMDA介导的神经毒性的一个意想不到的机制,并由此引出了一个新的靶点的识别和有效治疗缺血性脑卒中肽的开发。
该研究发现,NMDAR与离子通道TRPM2的耦合增强了NMDAR诱导的兴奋性毒性。TRPM2-NMDAR的关联促进了突触表面NMDAR的表达,导致NMDAR活性增强和神经元的死亡增加。为此,作者找到了TRPM2上一个特定的与NMDAR相互作用的模体(Motif),以此设计出一个穿膜肽来干扰/解耦TRPM2-NMDAR的相互作用,并证实该干扰肽能够减轻MCAO小鼠的脑损伤。该研究提供了一种非直接靶向NMDARs的方法来减轻缺血性脑卒中后神经元的兴奋性毒性凋亡。
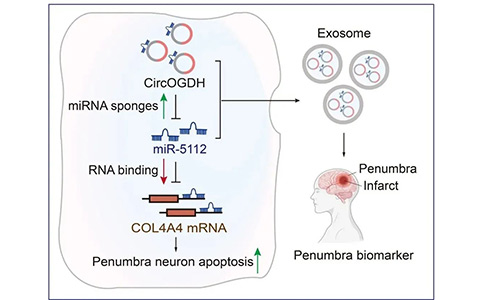
Circulation Research:CircOGDH可作为AIS潜在的半暗带生物标志物和治疗靶点
治疗急性缺血性脑卒中(Acute Ischemic Stroke, AIS)最重要的是在黄金时间窗口内重新疏通阻塞的血管,以挽救缺血的半暗带组织(Penumbra Tissue PEN)。如果在这段时间内没有进行再灌注疏通,PEN将发展为不可逆转的梗死灶。然而,由于AIS的高度异质性,PEN的存在可以在几个小时到几天之间变化。因此,检测PEN的存在对于帮助医生决定是否值得进行再灌注治疗是非常有价值的。目前,多模态成像方法可以用来预测半影是否存在。然而,在高端设备短缺的地区,仍然需要一种快速、容易获得的诊断方法来检测AIS患者PEN的存在。
2022年3月18日,暨南大学附属第一医院徐安定教授团队在《Circulation Research》期刊上发表了“CircOGDH Is a Penumbra Biomarker and Therapeutic Target in Acute Ischemic Stroke”的研究论文,该研究证实,环状RNA——CircOGDH(Circular RNA derived from Oxoglutarate Oehydrogenase)与PEN的存在密切相关。CircOGDH在大脑中动脉闭塞小鼠的PEN和AIS患者的血浆中的表达被显著上调;在AIS患者中,CircOGDH的表达与PEN的大小呈正相关。CircOGDH能够靶向结合miR-5112来促进下游COL4A4的高表达,从而加速PEN神经元凋亡;在缺血条件下,下调CircOGDH可显著增强神经元的活力。此外,脑组织中CircOGDH的表达与大脑中动脉闭塞小鼠血清中CircOGDH的表达密切相关;并且CircOGDH在AIS患者的血浆外泌体中高表达。
这些结果表明,CircOGDH是AIS的一个高敏感性、高特异性的生物标志物,并且有可能成为一个精准判断PEN大小的指标和调节缺血神经元活力的潜在治疗靶点。