AUTS2缺失引发社交障碍的发育和神经环路机制
文章概述
自闭症谱系障碍(Autism Spectrum Disorder, ASD)是一种神经发育疾病,ASD的发生涉及到遗传和环境等因素,其核心症状表现为社交障碍、重复刻板行为增加等行为异常。越来越多的研究认为,自闭症患者的社交障碍与面孔识别障碍有关,并且在普通人群中,面孔识别能力差与自闭症样的特质也存在一定的关联。到目前为止,海马(Hippocampus, HIP)被证实参与了面孔识别,但是在ASD相关的社交障碍中,其遗传风险和潜在的发育和神经环路机制尚不明确。2022年3月2日,北京大学第六医院张岱教授团队在《Science Advances》发表题为“Auts2 deletion involves in DG hypoplasia and social recognition deficit: The developmental and neural circuit mechanisms”的研究论文,该研究表明,Auts2基因缺失会导致小鼠出生后海马齿状回(Dentate Gyrus, DG)发育不全,并进一步导致乳头体上核(Supramammillary Nucleus, SuM)–DG–CA3(Corus Ammonis 3)环路的功能障碍,从而引发社交认知障碍。该研究揭示了ASD基因缺陷引发社交障碍的发育和神经环路机制。

核心观点
1、ASD高易感基因Auts2的缺失导致小鼠出生后的齿状回发育不全,而这与社会认知缺陷密切相关;
2、Auts2相关信号作为转录抑制因子在小鼠出生后DG发育的神经元迁移过程中发挥了重要作用;
3、Auts2缺失引起的DG发育不全可进一步导致SuM–DG–CA3环路的功能障碍;
4、通过药理学或者是化学遗传学/光遗传学手段激活SuM–DG环路,纠正了DG–CA3的突触传递,可以恢复Auts2缺失小鼠的社交识别能力。
研究结果分析
1. Auts2缺失导致小鼠DG发育不良和自闭症样行为
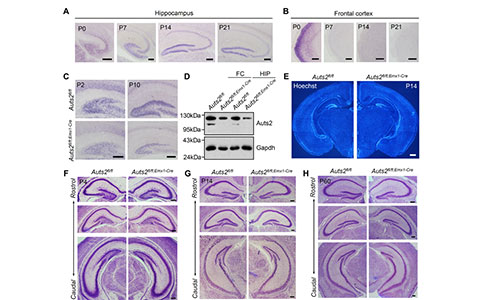
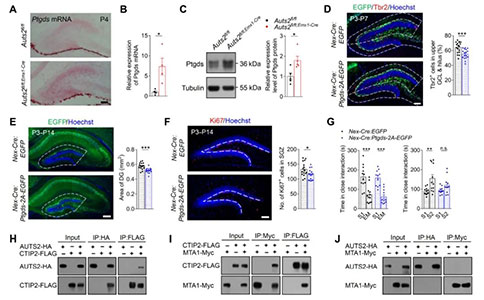
Auts2在HIP和额叶皮层(Frontal Cortex, FC)表达最为丰富。为了研究Auts2在前脑发育中的关键作用,研究者首先检测了Auts2在HIP和FC的表达模式。Auts2在DG中的表达在出生后不同天数明显增加,表明该基因在DG发育中可能发挥了重要作用。为此,研究者构建了前脑兴奋性神经祖细胞特异性Auts2拷贝数缺失的Auts2fl/fl;Emx1-Cre小鼠,来进一步研究Auts2在小鼠出生后DG发育中的作用。
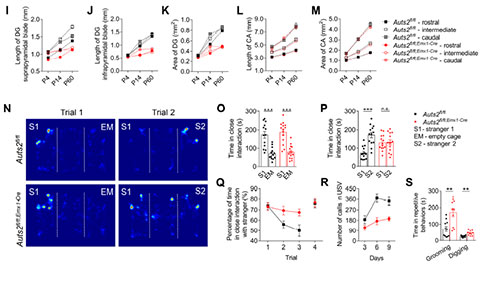
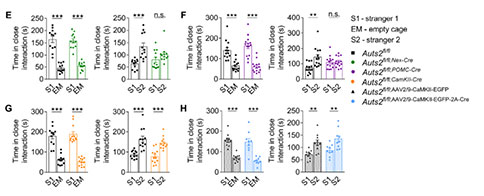
组织形态学分析显示,Auts2fl/fl;Emx1-Cre小鼠大脑冠状切片上DG的大小明显减小。其中,上锥体叶(Suprapyramidal Blades)和下锥体叶(Infrapyramidal Blades)的长度以及DG的面积在P14和P60明显减少。CA区域的长度和面积没有影响。这些结果表明,Auts2在小鼠出生后DG发育中发挥着关键和特定的作用。另一方面,研究者评估了Auts2缺失对ASD相关行为的潜在影响。在三箱社交实验(Social Interaction, SI)中,雄性Auts2fl/fl;Emx1-Cre小鼠表对陌生小鼠表现出正常的自愿接触,但是其社交辨别能力受损,表现出对熟悉小鼠的适应以及新出现小鼠的不适应行为损害,证实了Auts2在社交识别记忆中是必需的。并且,雄性Auts2fl/fl;Emx1-Cre小鼠在气味和新奇物体的识别的测试中都表现正常,这表明Auts2缺失影响的是社交识别,而不是气味或新奇物体的识别。同样,雌性Auts2fl/fl;Emx1-Cre小鼠也表现出社交识别障碍。此外,隔离诱导Auts2fl/fl;Emx1-Cre小鼠幼崽超声波发声的次数在不同出生后天数也明显低于对照组幼崽。在Auts2fl/fl;Emx1-Cre小鼠还表现出过度梳理和挖掘行为。这些结果表明,Auts2缺失导致小鼠出现社交异常、刻板行为增加。
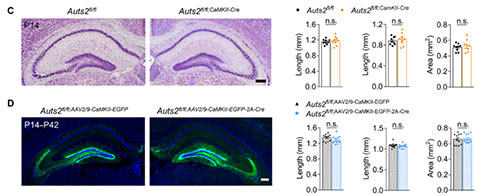
2. Auts2缺失引起的小鼠DG发育不全与社会认知障碍密切相关
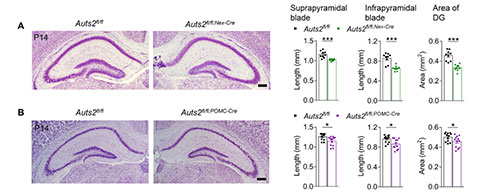
由于Auts2在有丝分裂后的颗粒细胞(Granular Cells, GCs)中高表达,研究者进一步构建了Nex–Cre、Pomc–Cre以及CaMKII–Cre条件性依赖的Auts2缺失小鼠,这些小鼠在不同的发育阶段和不同的前脑区出现Auts2缺失。我们发现Auts2fl/fl;Nex-Cre和Auts2fl/fl;Pom-Cre小鼠在P14同样出现DG发育不全,这与Auts2fl/fl;Emx1-Cre小鼠的结果一致。然而,无论是Auts2fl/fl;CaMKII-Cre小鼠,还是病毒介导的Auts2缺失(P14)小鼠,DG形态均显示正常的。这些结果证实了GCs中Auts2的功能对出生后早期DG的发育至关重要。为了进一步研究Auts2缺失介导的DG发育不全与ASD核心症状的潜在关联,研究者对上述小鼠进行了SI评估,其中Auts2fl/fl;Nex-Cre和Auts2fl/fl;Pom-Cre小鼠表现出社交识别障碍,Auts2fl/fl;CaMKII-Cre小鼠并未观察到社交识别异常。此外,在Auts2fl/fl;Nex-Cre小鼠中也观察到过度梳理行为。这些结果表明,Auts2缺失诱导的DG发育不良与社会认知缺陷密切相关。
3. Auts2缺失导致SGZ的形成受损
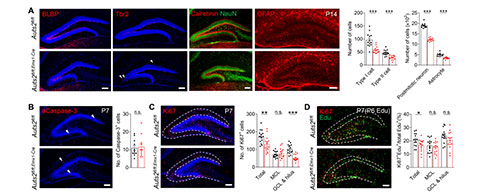
通过对细胞组成进行分析显示,Auts2fl/fl;Emx1-Cre小鼠DG中脑脂质结合蛋白阳性(Brain Lipid Binding Protein Positive, BLBP+)的神经干细胞(Neural Stem Cells, NSCs)、T-box转录因子T-brain 2阳性(T-box Transcription Factor T-brain 2 Positive, Tbr2+)的中间前体细胞(Intermediate Precursor Cells, IPCs)、有丝分裂后的Calretinin+(未成熟)/NeuN+(成熟)神经元、以及胶质纤维酸性蛋白阳性(Glial Fibrillary Acidic Protein Positive, GFAP+)的星形胶质细胞在P14时显著减少,但是这些细胞的相对百分比与对照并没有显著差异。这些结果表明,Auts2缺失影响的是细胞数量,而不是细胞亚群比例。
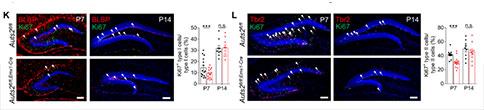
DG发育不全可能与细胞的增殖、分化、凋亡、迁移等调控过程的异常有关。对Caspase-3染色排除了凋亡的影响。通过对Ki67+染色观察到Auts2fl/fl;Emx1-Cre小鼠DG颗粒细胞层(Granular Cell Layer, GCL)中细胞增殖的数量显著降低(P7)。同样,细胞周期分析实验也显示Auts2fl/fl;Emx1-Cre小鼠与对照小鼠之间存在区域特异性的差异,提示可能与细胞迁移受损有关。此外, Auts2fl/fl;Emx1-Cre小鼠GCL中存在异位的Tbr2+细胞(P14),因此,研究者检测了小鼠出生后不同阶段IPC的迁移情况。在P2时,Auts2fl/fl;Emx1-Cre小鼠Tbr2+IPCs的分布模式与对照小鼠类似,这表明此时Auts2fl/fl;Emx1-Cre小鼠中NSCs/IPCs沿齿状迁移流和软膜下区(Subpial Zone, SPZ)形成的正常切向迁移。在P7时,Auts2fl/fl;Emx1-Cre小鼠径向迁移到GCL中的Tbr2+细胞比例与对照相比减少了一半,伴随着许多Tbr2+细胞堆积在SPZ(P5和P7),表明齿状神经源细胞没有经历从SPZ向颗粒下层(Subgranular Zone, SGZ)的过渡。这进一步导致Auts2fl/fl;Emx1-Cre小鼠在P14和P60的SGZ形成受损和神经发生减少。此外,在Auts2fl/fl;Nex-Cre和Auts2fl/fl;Pom-Cre小鼠中也观察到Tbr2+IPCs从SPZ迁移到SGZ受损,表明细胞自主和非细胞自主行为可能参与到Auts2缺失介导的SPZ–SGZ过渡损害。然而, Auts2缺失的细胞在胚胎期表现出正常的从齿状神经上皮细胞向发育中的DG迁移。NSCs和IPCs的增殖速率只在P7显著减少,提示P7时NSCs和IPCs的增殖能力下降可能是由于它们从SPZ向SGZ迁移的缺陷所致。

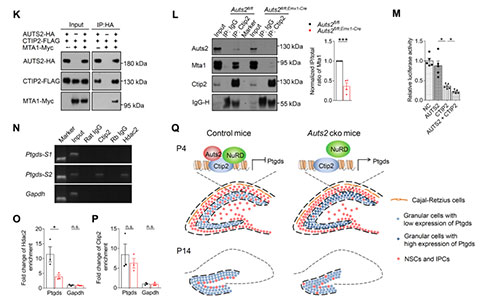
4. Auts2–Ctip2–NuRD复合体抑制Ptgds的转录,并参与NSCs/IPCs从SPZ向SGZ的迁移
探索Auts2缺失介导DG发育不全潜在的分子机制,研究者用到了微阵列转录组技术来分析Auts2fl/fl;Emx1-Cre小鼠DG中表达上调和下调的基因。研究者重点探讨了前列腺素D2合酶(Prostaglandin D2 Synthase, Ptgds),该基因在Auts2fl/fl;Emx1-Cre、Auts2fl/fl;Nex-Cre以及Auts2fl/fl;Pom-Cre小鼠的DG中表达升高。利用病毒载体,在早期有丝分裂后的GCs中过表达Ptgds后观察到:Tbr2+IPCs从SPZ向SGZ内迁移异常、P7 时DG发育不全、以及P14时SGZ形成异常。这与Emx1–Cre、Nex–Cre或Pomc–Cre所介导DG中Auts2条件缺失得情形类似。此外,在Ptgds过表达小鼠中也观察到社交识别缺陷。这些结果表明,在早期有丝分裂后得GCs中适当水平的Ptgds表达对Auts2依赖的出生后DG的发育是至关重要的。Ctip2是一种转录抑制因子,受核小体重构和去乙酰化酶(Nucleosome Remodeling and Deacetylase, NuRD)复合体的调控,它参与了DG的形成,并在神经发育过程中与AUTS2共定位。本研究中,研究者确定了Ptgds受到Ctip2和Auts2共同调控的,表明在Auts2缺失时,Ctip2–NuRD复合体在Ptgds上调中的潜在作用。免疫共沉淀分析观察到,CTIP2能够与AUTS2和MTA1(Metastasis Associated 1; NuRD复合体的一个成员)相互作用。然而,除非共转染CTIP2,否则AUTS2不与MTA1相互作用,这表明CTIP2可以介导AUTS2与MTA1之间的相互作用。进一步分析体内蛋白-蛋白的相互作用,观察到对照组DG中CTIP2与MTA1和AUTS2相互作用,然而AUTS2缺失显著削弱了MTA1与CTIP2的相互作用。
荧光素酶实验表明,过表达CTIP2比过表达AUTS2更能抑制体外PTGDS启动子介导的荧光素酶表达。然而,AUTS2可以显著提高CTIP2对PTGDS的抑制能力。此外,染色质免疫沉淀实验表明,CTIP2和组蛋白去乙酰化酶2(Histone Deacetylase 2, Hdac2; NuRD复合体中的两个组蛋白去乙酰化酶之一)都能直接结合到对照组DG中Ptgds的启动子上。Auts2缺失在很大程度上减少HDAC2而不是CTIP2与Ptgds启动子的结合。这些结果表明,在有丝分裂后的GCs中,通过将NuRD复合物招募到启动子上,Auts2是Ctip2介导的Ptgds抑制所必需的,该过程涉及到在出生后早期DG中NSCs/IPCs迁移。在Auts2缺失小鼠中,GCs中Ptgds的异常表达导致SPZ向SGZ的转变异常以及DG的发育不全。
5. DG发育不良引起的DG–CA3突触传递减少与社交识别障碍有关
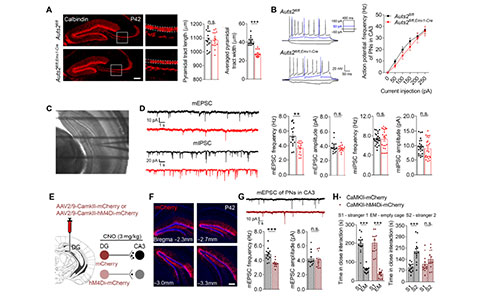
为了揭示DG发育不全对海马神经环路的影响,研究者首先确定了GCs的形态学和电生理特征。Auts2fl/fl;Emx1-Cre小鼠GCs轴突末端的数量显著减少,Auts2缺失不影响GCs树突长度和复杂性。此外,Auts2fl/fl;Emx1-Cre小鼠GCs中记录的微小兴奋性突触后电流(mEPSCs)和微小抑制性突触后电流(mIPSCs)的频率和振幅也显示正常。
为了进一步确定DG–CA3之间的神经传递和CA3中锥体神经元(Pyramidal Neurons, PNs)的兴奋性,研究者记录了动作电位、mEPSCs和mIPSCs。Auts2fl/fl;Emx1-Cre小鼠PNs的mEPSC频率而不是振幅显著降低,而动作电位的频率和mIPSCs的频率和振幅均未受影响。这些结果表明,Auts2fl/fl;Emx1-Cre小鼠突触前依赖的DG–CA3突触传递受损,而不是短期可塑性受损。
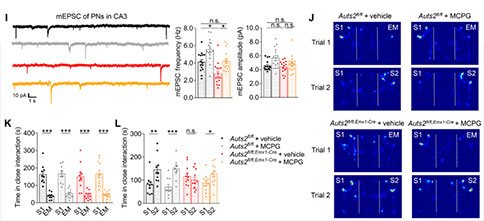
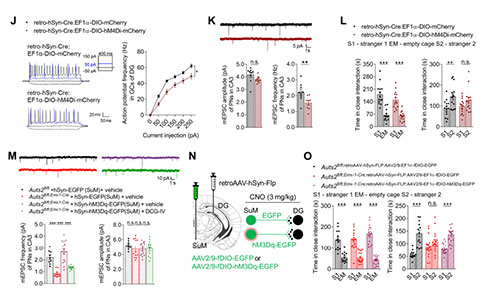
为了探讨DG–CA3环路对社交识别行为的影响,研究者在成熟的野生型GCs中过表达抑制性的hM4Di受体介导的化学遗传学来抑制神经活动,并观察到CA3中PNs的mEPSCs频率明显降低。与对照组相比,给药后表达hM4Di受体小鼠的社交识别能力受损,但没有损害期新物体识别能力。此外,给予MCPG(突触前代谢性谷氨酸受体mGluR的拮抗剂)靶向DG–CA3的苔藓纤维可阻断DG–CA3突触前递质释放抑制,从而促进DG–CA3突触传递。在Auts2fl/fl;Emx1-Cre小鼠双侧DG–CA3末端注射MCPG后,小鼠的社交识别障碍得到了很大程度的恢复,提示DG发育不全引起DG–CA3突触传递减少与社交识别障碍有关。
6. SuM–DG环路活动能够调节DG–CA3突触传递以及社交识别行为
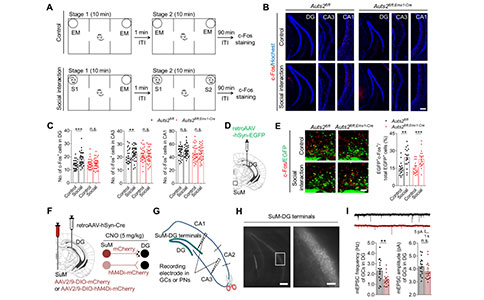
为了进一步探讨DG发育不全参与ASD相关社交认知缺陷的神经环路机制,研究者首先评估了HIP神经元的活性,在SI测试后,Auts2fl/f小鼠DG的GCL层和CA3的PN中C-fos+细胞的数量显著高于Auts2fl/fl;Emx1-Cre小鼠。随后,研究者利用逆行病毒示踪寻找潜在的与社交识别相关的DG上游脑区,相关脑区包括SuM、外嗅皮层(Lateral Entorhinal Cortex, LENT)和内嗅皮层(Medial Entorhinal Cortex, MENT)。值得注意的是,在SI测试后,Auts2fl/f小鼠和Auts2fl/fl;Emx1-Cre小鼠的SuM的神经元被激活,而非LENT或MENT的神经元。
为了确定抑制SuM–DG环路是否会影响DG–CA3突触传递和社会识别行为,研究者通过表达hM4Di受体来抑制该环路中的神经元活动。在抑制向DG投射的SuM神经元后,DG中的GCs兴奋性和DG–CA3环路的突触传递显著降低,并且观察到了社交识别受损。此外,利用过表达的hM3Dq受体激活SuM-DG环路,可以显著恢复Auts2fl/fl;Emx1-Cre小鼠CA3 中PNs的mEPSC频率。DG–CA3末端突触前给予DCG-IV(一种mGluR受体激动剂)可阻断其拯救作用,提示其拯救作用是由于对DG–CA3突触传递的促进作用。这些结果表明,通过调节SuM–DG环路的神经元活动,可以调节DG–CA3的突触传递。DG发育不良引起的SuM–DG–CA3环路的神经传递不足可能是Auts2缺失小鼠社交行为异常的潜在机制。
7. 记忆编码阶段调控SuM–DG环路活动能够调节社交识别行为
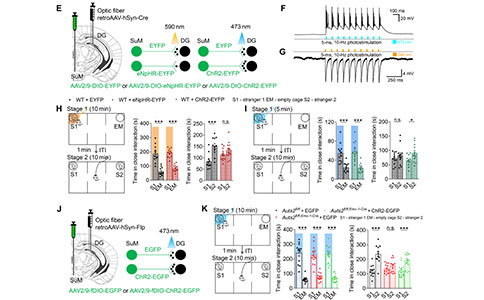
研究者进一步利用光纤记录系统记录了自然状态下SuM(投射到DG)神经元的活性,受试小鼠在第一阶段初次接触陌生小鼠时会产生一个明显强劲的钙信号,而在后续第二阶段与两只不同小鼠接触时产生了几乎相同的温和钙信号。这些结果表明投射到DG的SuM神经元参与了社交行为。
为了阐明SuM–DG环路参与社交识别行为的具体阶段,研究者利用过表达光通道蛋白(ChR2和 eNpHR)分别激活或抑制SuM–DG末端,并通过记录SuM神经元的光诱发动作电位和膜电位变化来评估激活和抑制的效果。研究者发现,当野生型小鼠在SI第一阶段与陌生小鼠密切互动时,抑制其SuM–DG末端会导致社交新奇显著受损。此外,在改良的SI试验中,在第一阶段激活野生型小鼠SuM–DG末端促进了第二阶段对新出现小鼠的偏爱。在Auts2fl/fl;Emx1-Cre小鼠中,在第一阶段激活其SuM–DG末端恢复了小鼠在第二阶段对新出现小鼠的偏爱。这些结果表明,在记忆编码阶段,调控SuM–DG环路活性可以充分调节社交识别行为。
总结
亮点研究方法