文献速读 | 睡眠调控机制研究新进展
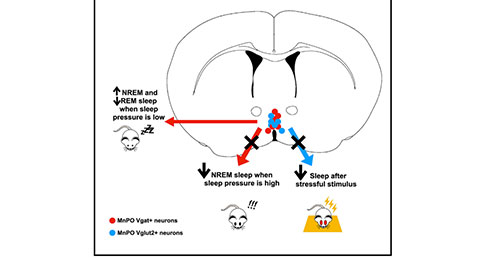
Current Biology:阐述下丘脑中位视前核不同类型神经元在睡眠调控中的作用
睡眠对于维持最佳的大脑功能乃至身心健康至关重要。以往的研究表明,下丘脑中位视前核(Median Preoptic Nucleus, MnPO)在调节觉醒-睡眠周期,特别是在睡眠稳态驱动方面发挥着重要作用。已有的研究证实,兴奋性和抑制性MnPO神经元都能够支配与睡眠促进和维持有关的大脑区域,这表明这两种类型神经元都可能参与了睡眠控制。然而,MnPO神经元调控觉醒-睡眠周期的精确细胞表型、靶点和中枢机制仍不清楚。
2022年4月5日,哈佛医学院的研究人员在《Current Biology》期刊上发表了“Median preoptic GABA and glutamate neurons exert differential control over sleep behavior”的研究论文,该研究利用遗传学方法,探讨了MnPO 中GABA能(MnPOVgat)和谷氨酸能(MnPOVglut2)神经元在调节小鼠清醒-睡眠行为中的作用。
其研究结果显示,这两种神经元在参与觉醒-睡眠控制过程中存在差异,其中MnPOVgat神经元参与了睡眠稳态控制,而MnPOVglut2神经元则能够在压力应激状态下促进睡眠。该研究的结果进一步澄清了MnPO中不同神经元在睡眠控制中的作用。
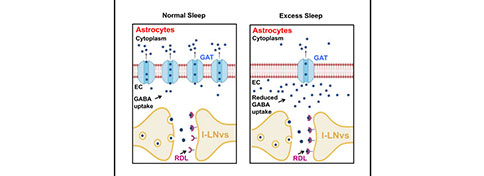
Current Biology:揭示星形胶质细胞GABA转运体参与睡眠调控新机制
调节人类和其它动物的睡眠行为有两个关键因素:昼夜节律控制和睡眠稳态,它们的精确协调决定了睡眠节律和睡眠时间。在激活促进觉醒和促进睡眠神经元之间进行微调是觉醒-睡眠周期调节的一个重要机制。众所周知,GABA在控制睡眠过程中发挥着保守而又关键的作用,因此,在睡眠回路中,GABA能的活动应该受到严格控制。迄今为止,大多数已经证实的睡眠调节途径、分子和神经递质均存在于神经元中,然而,越来越多的证据表明神经胶质细胞在睡眠调节中具有重要的作用,尽管这种作用还不明确。
2022年3月17日,麻省大学医学院的研究人员在《Current Biology》期刊上发表了一篇题为“Astrocytic GABA transporter controls sleep by modulating GABAergic signaling in Drosophila circadian neurons”的研究论文。在该研究中,作者利用黑腹果蝇研究了星形胶质细胞GABA转运体(GABA Transporter, GAT)在睡眠调节中的作用。研究发现,星形胶质细胞中一种亚等位基因的gat突变增加了果蝇的夜间睡眠时间,减少了睡眠潜伏期,并增加了睡眠稳态。星形胶质细胞GAT通过与 GABAA受体上游的调控分子相互作用,能够维持适当GABA活动并作用于促进觉醒的节律神经元(large ventral Lateral Neurons, l-LNvs)。
这些结果表明,星形胶质细胞GAT可通过降低觉醒时GABA的活动来促进昼夜节律神经元的活性,从而保证果蝇适当的睡眠时间和质量。该研究工作揭示了一种睡眠调节的新机制。
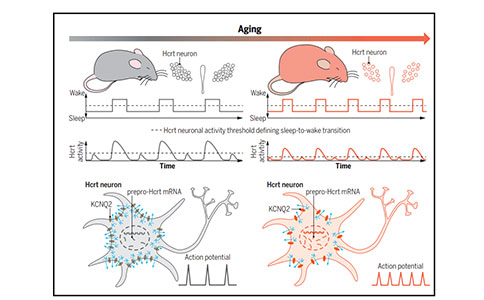
Science:衰老与睡眠障碍——过度兴奋的唤醒环路引起的睡眠碎片化
睡眠不稳定与衰老以及认知功能衰退密切相关,尽管睡眠碎片化是老年人群中最普遍的睡眠问题,但睡眠不稳定的机制仍不清楚。不同物种在衰老过程中都表现出睡眠碎片化,这表明在系统发育中存在一种保守的潜在机制能够诱导睡眠不稳定。因此,理解大脑在衰老过程中无法巩固睡眠的原因,可能有助于我们改善老年人的睡眠质量。
2022年2月25日,斯坦福大学医学院的研究人员在《Science》期刊上发表题为“Hyperexcitable arousal circuits drive sleep instability during aging”的文章。该研究发现,在衰老过程中,过度兴奋的下视丘分泌素/食欲素(Hypocretin/Orexin, Hcrt/OX)神经元能够驱动睡眠碎片化。在老年小鼠中,Hcrt神经元表现出更频繁的神经元活动并且会导致觉醒,而且利用光遗传来激活Hcrt神经元造成了更长时间的觉醒。老化的Hcrt神经元表现出超常的兴奋性以及KCNQ2离子通道蛋白表达降低,并伴有由KCNQ2/3通道介导的M电流受损。单核RNA测序还显示老化大脑中存在Hcrt神经元丢失的适应性改变。此外,破坏年轻小鼠大脑Hcrt神经元中的Kcnq2/3基因会导致睡眠不稳定,类似于衰老相关的睡眠碎片化;而选择性的激活KCNQ通道会使老年小鼠的Hcrt神经元超极化,并恢复睡眠的稳定性。
该研究结果揭示了在衰老过程中存在一种睡眠不稳定的机制,以及一种改善睡眠质量的策略。
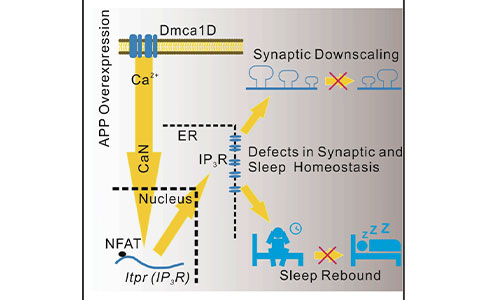
Cell Reports:IP3受体在APP所致突触缩放和睡眠稳态缺陷中的调控机制
睡眠对于维持正常的认知功能极其重要,一般认为,睡眠有助于突触缩放从而使突触强度恢复正常。有证据表明,突触和放电稳态受损是阿尔茨海默病(Alzheimer’s disease, AD)早期进展的一个驱动,然而,这种稳态受损的机制目前仍不清楚。
2022年3月29日,上海交通大学平勇研究团队在《Cell Reports》期刊上发表了一篇题为“Upregulation of IP3 receptor mediates APP-induced defects in synaptic downscaling and sleep homeostasis”的研究论文,该研究利用过表达人源淀粉样蛋白前体蛋白(Amyloid Precursor Protein, APP)的果蝇AD模型来研究突触以及睡眠的稳态。APP过表达能够引起家族早发性AD,并诱导突触出现过度兴奋。RNA测序数据显示,APP突变体中与钙离子信号相关的基因的表达增加,包括编码Dmca1D、CaN、以及IP3R的基因。作者进一步证实,CaN活性的增加可通过激活的T细胞核因子来触发Itpr(IP3R)的转录激活。并且,APP过表达会导致突触缩放以及睡眠剥夺所致的睡眠反弹出现障碍,而这两种障碍都可以通过抑制IP3R来恢复。
该研究结果表明,IP3R是突触缩放和睡眠稳态中的一个共享信号分子,其异常调节可导致突触过度兴奋和早期AD进展。