为什么社恐?可能是你年少时没睡好
文章概述
人的一生中大约三分之一的时间在睡觉,睡眠对于维持机体正常的生理功能十分重要。睡眠的功能包括代谢恢复、解毒、突触可塑性调节和记忆巩固等。神经发育障碍,如自闭症谱系障碍、精神分裂症等,常常会导致睡眠障碍,包括睡眠启动延迟、睡眠时间缩短和睡眠碎片化等问题,而发育性的睡眠障碍和成年行为异常之间的因果关系仍然难以确定。2022年5月26日,斯坦福大学的研究人员在《Nature Neuroscience》杂志上发表题为“Adolescent sleep shapes social novelty preference in mice”的文章。文章作者通过光纤记录、体外电生理和化学遗传学等手段,证实了青少年时期睡眠中断(Sleep Disruption, SD)会导致与社交互动行为密切相关的腹侧被盖区(Ventral Tegmental Area, VTA)多巴胺能环路出现一系列的长期功能和结构变化,并导致社交新奇偏好损害。这种发育性睡眠功能受到青春期VTA活动的调节,激活VTA模拟了青春期SD引起社交缺陷,而沉默VTA则拯救了青春期SD引起社交缺陷。最后,作者利用自闭症小鼠模型证明,修复青春期睡眠或纠正VTA的活动可以改善成年后的社交缺陷。
核心观点
2、青春期VTA激活模拟了青春期SD引起社交缺陷,而VTA沉默则拯救了青春期SD引起社交缺陷;
3、在自闭症小鼠模型中,修复青春期睡眠或纠正VTA的活动拯救了小鼠成年后的社交缺陷。
研究结果分析
1. 青春期SD会影响小鼠成年后的社交新奇偏好
为了研究青少年时期的SD是否会影响成年后的社交行为,作者利用自动睡眠剥夺系统来干扰动物的睡眠,并通过三箱社交实验来检测动物的社交能力和社交新奇偏好。研究结果显示,青春期SD不会影响小鼠的社交能力,但是会损害小鼠的社交新奇偏好。这种社交新奇偏好的缺陷不是由于与睡眠剥夺相关的慢性压力造成的,因为在青春期的慢性束缚压力并没有导致类似的缺陷。青春期SD对社交新奇偏好的影响持续时间较长,在初次实验4周后仍然能够检测检测到SD小鼠社交新奇偏好缺陷。将同样的SD方案应用于成年小鼠并不能导致动物社交能力或社交新奇偏好方面的任何缺陷,这表明社交新奇偏好要求小鼠在青春期的睡眠不受干扰,而非成年时期。
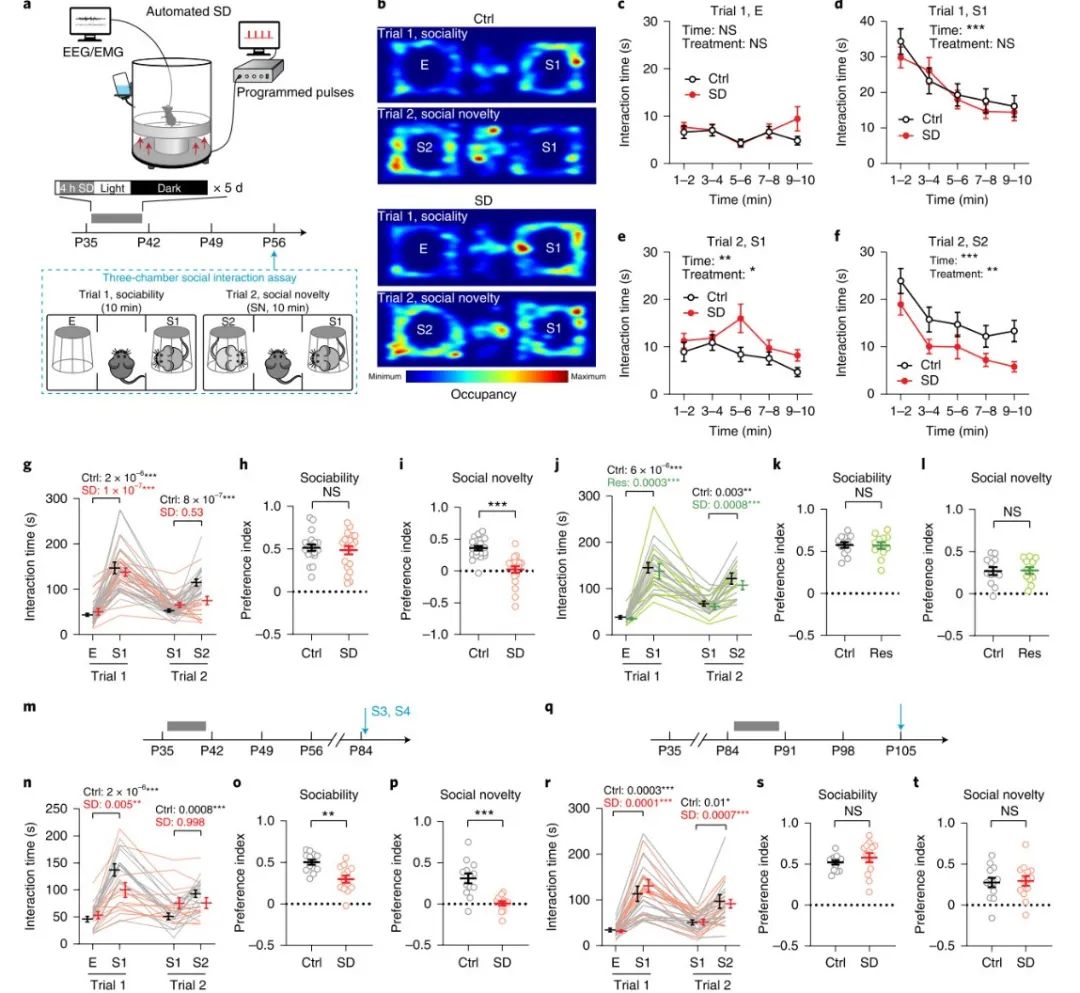
2. 青春期SD能够削弱小鼠与社交新奇性相关的VTA激活
为了搞清楚哪些大脑结构可能是青春期SD引起的社交新奇偏好缺陷的基础,作者利用光纤记录系统检测了与社交互动密切相关的VTA 多巴胺能神经元的活动情况。作者发现VTA 多巴胺能神经元的整体活性并没有变化,然而,当追踪到每个相互作用时,作者在对照组小鼠中发现了一种依赖于社交新奇性的VTA激活模式,而在SD组小鼠中则没有。当测试小鼠遇到第一次社交刺激时,对照组小鼠VTA多巴胺能神经元表现出显著的激活,但这些神经元的反应随着社交互动的增加迅速呈指数下降。当对照小鼠遇到第二次新的陌生小鼠时,VTA多巴胺能神经元显著反应再次出现,并再次迅速下降,而已经熟悉的小鼠没能引起VTA神经元的明显反应。然而,在SD小鼠中,小鼠第一次遇到陌生小鼠时VTA多巴胺能神经元的反应明显减弱,而在第二次遇到新的陌生小鼠时VTA神经元的反应完全消失。并且作者注意到,在SD组中,大量的Ca2+活动仍然发生,但与社交互动事件没有时间上的一致性,这表明VTA的激活与社交新奇性脱钩。

3. 青少年SD导致小鼠社交互动中的多巴胺的释放受损
VTA多巴胺能神经元在处理社会奖励和调节社交行为方面的作用依赖于它们在中皮层的下游投射,包括伏隔核(Nucleus Accumbens, NAc)和前额叶皮层(Prefrontal Cortex, PFC)。为了检测NAc是否是青春期SD引发社交障碍的靶点,作者利用多巴胺探针传感器来直接测量NAc中的多巴胺释放,结果显示,NAc中的多巴胺释放与VTA神经元反应模式一致。SD小鼠遇到第一次社交刺激时,NAc中的多巴胺释放异常升高,而在遇到第二次新的社交刺激时,NAc中的多巴胺释放信号受损。
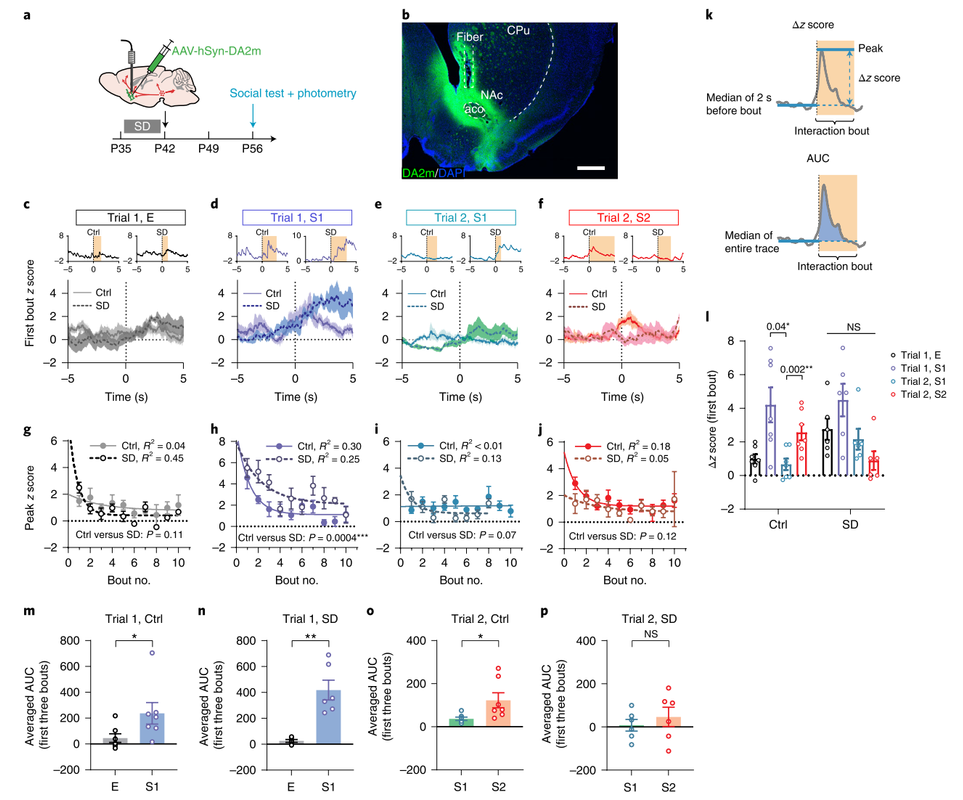
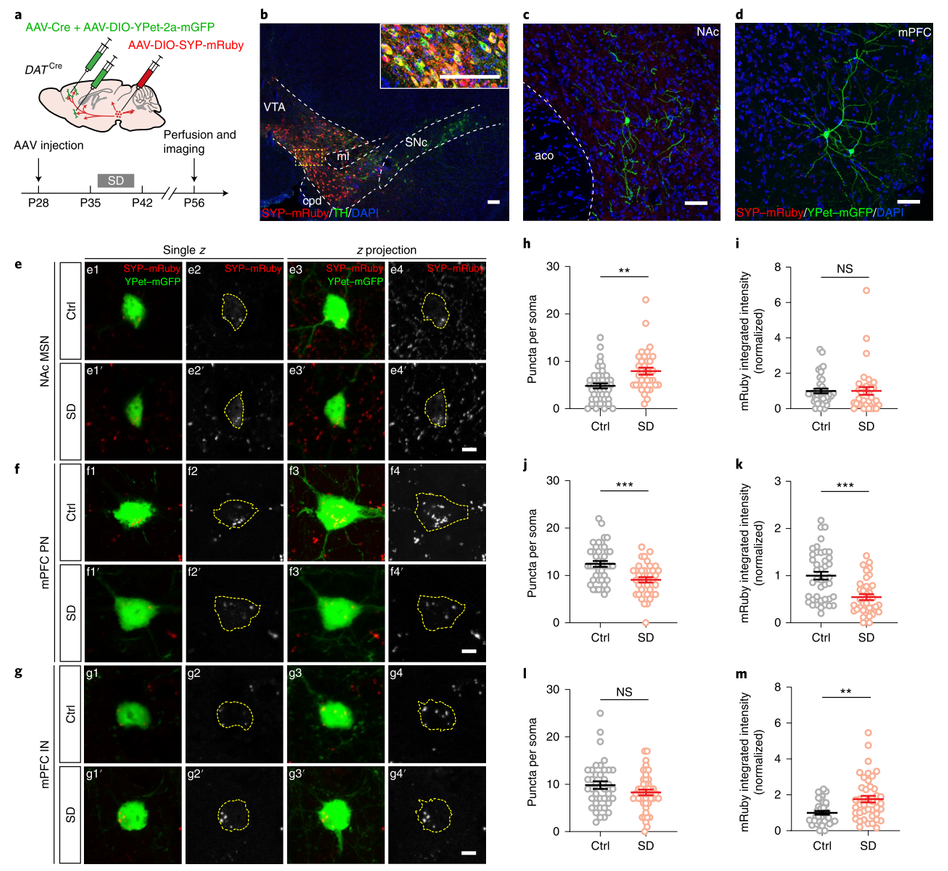
4.青春期SD会改变VTA的神经投射轮廓
因为青春期SD会导致成年后长期的社交缺陷和NAc中异常的多巴胺释放,因此,作者假设青春期SD会引发VTA投射环路永久性的结构变化。作者使用双标记策略检测了VTA 多巴胺能神经元到NAc和mPFC的投射。与NAc中多巴胺释放异常增加的结果一致,SD小鼠NAc中的中型多棘神经元受VTA的神经支配增加,而mPFC中的锥体神经元受VTA的神经支配减少,其中间神经元没有变化。这些形态学特征表明,SD诱导的VTA投射靶点的结构变化对社交互动至关重要。
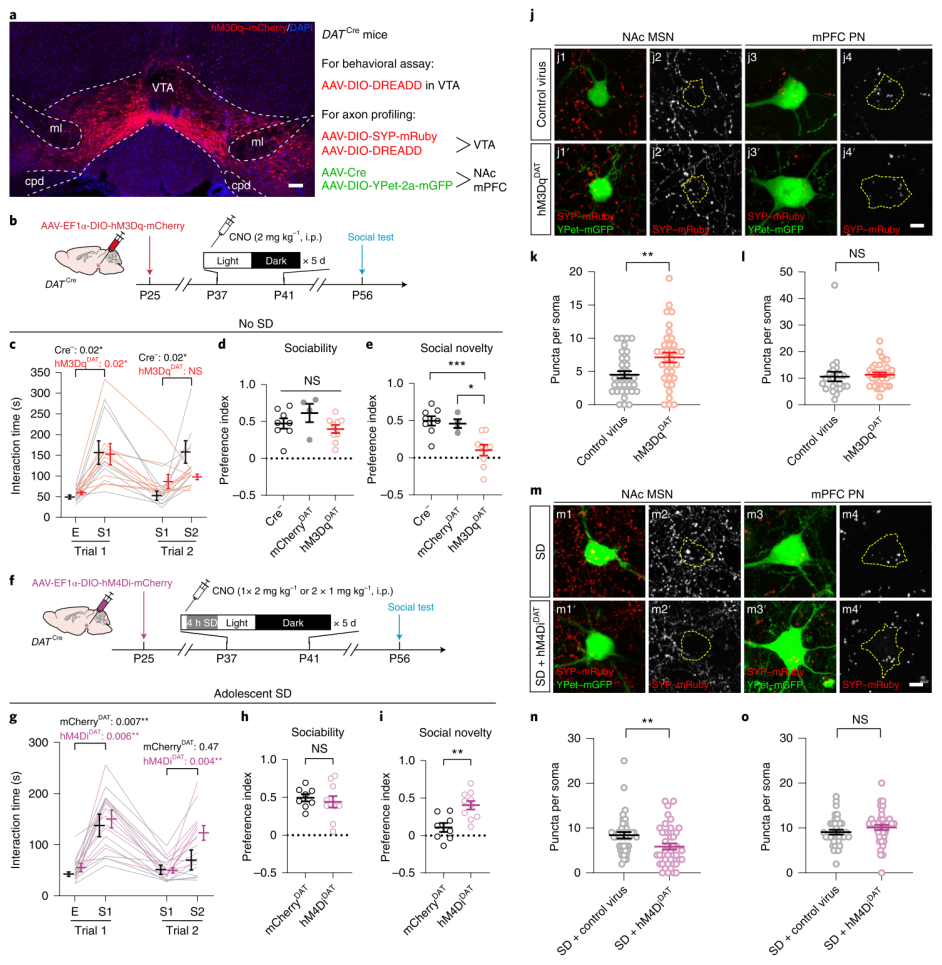
5. 青春期VTA的活动对小鼠社交新奇偏好的形成至关重要
VTA多巴胺神经元在清醒时高度活跃,但在睡眠时基本沉默,青春期SD导致VTA过度兴奋。因此,作者考虑在青春期通过连贯的睡眠/觉醒周期维持VTA平衡活动水平是否对塑造社交新奇偏好至关重要。为此,作者首先检测了在青春期直接过度刺激VTA 多巴胺能神经元是否足以导致成年后的社交互动缺陷。通过化学遗传学手段特异性的激活VTA能够导致动物社交新奇偏好的丧失,但不影响其整体社交能力。因为激活VTA减少了非快速眼动睡眠,这可能是其他环路受到睡眠减少/清醒增加的影响重现了SD行为表型。为了排除这种可能性,作者利用化学遗传学手段特异性的抑制了青春期SD小鼠VTA的激活,VTA多巴胺能神经元抑制恢复了SD小鼠的社交新奇偏好。这些结果表明,青春期睡眠会影响VTA多巴胺能神经元对社交新奇偏好的塑造,而在青少年关键时期,VTA活动的均衡是调节这一关键睡眠功能所必需和充分的。除了行为学结果之外,作者还发现了与上述结果一致的形态学改变,VTA被特异性激活后,小鼠NAc中多巴胺能神经支配增加,而VTA特异性抑制则导致SD小鼠NAc中多巴胺能神经支配减少。
6. 修复青春期睡眠拯救了自闭症小鼠的社交缺陷
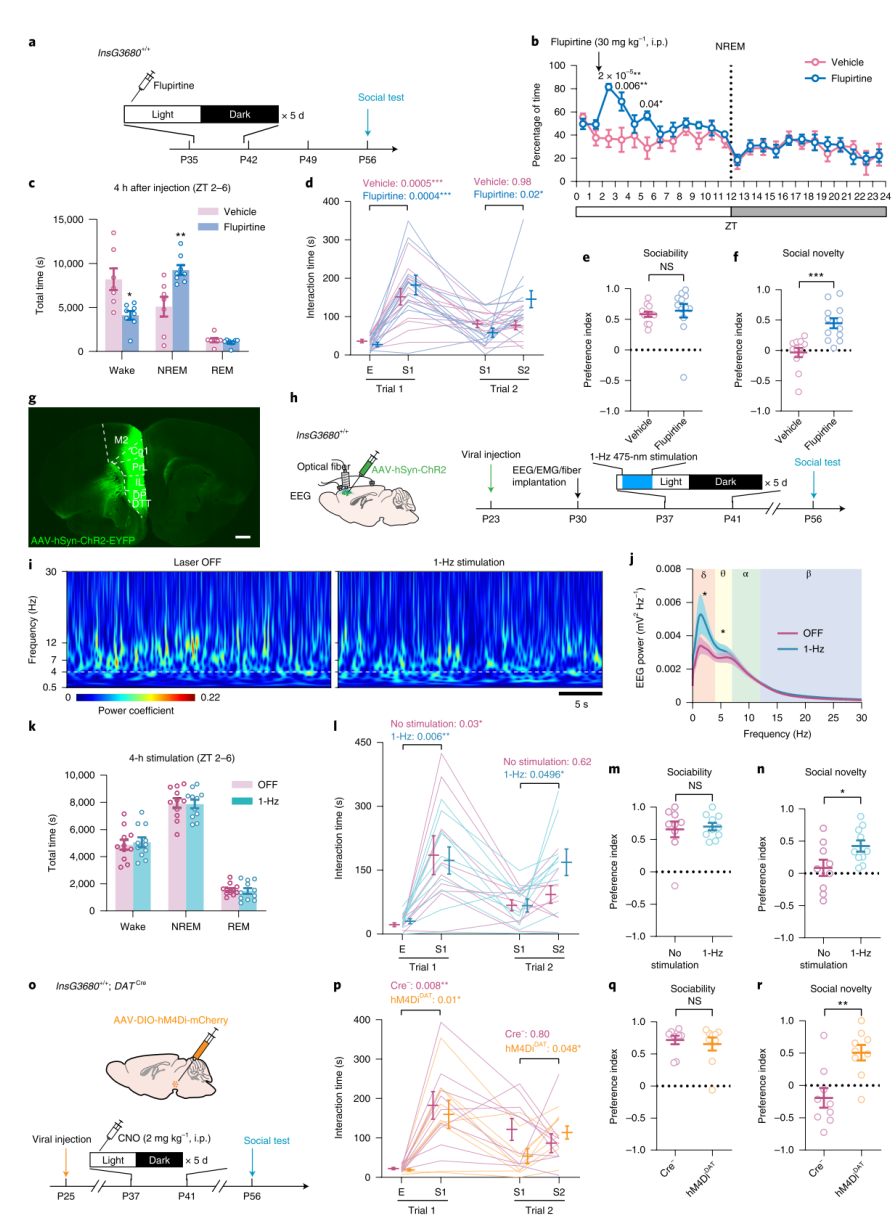
在确定了持续干扰青春期睡眠会损害社交新奇偏好、VTA-NAc环路的社交新奇性反应以及成年后VTA投射轮廓后,作者想进一步了解睡眠异常是否会在青春期自发地发生在神经发育障碍动物模型中,以及恢复青春期睡眠是否可以挽救这些动物的社交缺陷。为此,作者使用了一个自闭症小鼠模型(InsG3680+/+小鼠)。与同窝野生型小鼠相比,InsG3680+/+小鼠清醒时间更多,非快速眼动睡眠更少,在NAc中的多巴胺能神经支配增加,VTA轴突表型类似于青春期SD小鼠以及异常的VTA兴奋。接下来,作者利用氟吡汀来纠正InsG3680+/+小鼠的青春期睡眠缺陷。氟吡汀显著增加了InsG3680+/+小鼠非快速眼动的时间,降低了清醒时间,使得小鼠睡眠时间的完全补偿达到了与野生型小鼠相当的水平。重要的是,在青春期给予氟吡汀的InsG3680+/+小鼠,其社交新奇偏好完全恢复。此外,作者在不改变睡眠/清醒状态总时间的情况下,通过增加InsG3680+/+小鼠特定的睡眠成分(皮层慢波活动,SWA),完全恢复了小鼠的社交新奇偏好。由于抑制VTA活动可拯救青春期SD小鼠的社交缺陷,作者进一步通过化学遗传学抑制了InsG3680+/+小鼠青春期VTA的活动,小鼠的社交缺陷得以恢复。因此,作者证明了改善非快速眼动睡眠以及减少青春期关键期VTA活动可以恢复自闭症小鼠的社交新奇偏好。
总结
研究方法亮点













