反向助攻,内源性镇痛失败促进病理性疼痛的形成
文章概述
疼痛是机体的一种预警系统,能够保护生物体免受真实或潜在的组织损伤。在过度疼痛的情况下,由于内源性镇痛系统的存在,这种不愉快的感觉可以有效地被控制。越来越多的证据表明,内源性镇痛的失败可能是一些病理性疼痛超敏反应的基础,但其潜在机制仍不清楚。2022年7月27日,法国波尔多大学的研究人员在《Science Advances》杂志上发表题为“Switch of serotonergic descending inhibition into facilitation by a spinal chloride imbalance in neuropathic pain”的文章。在该研究中,作者通过光遗传学技术来调控Naïve和神经病理性疼痛动物的5-HT下行通路,揭示了内源性血清素源性疼痛调节不稳定的机制。以已知的投射到脊髓背角(dorsal horn of the spinal cord, DHSC)的中缝核(Nucleus Raphe magnus, RMg)血清素能(5-HT)神经元为目标。作者发现,这一特定群体可通过激活局部脊髓抑制性中间神经元来介导下行抑制。在神经损伤的动物中,由于脊髓氯失调,这种下行抑制转变为下行易化。通过使脊髓氯稳态正常化可以恢复5-HT神经元的下行抑制,并使得5-HT再摄取抑制剂(Selective Serotonin Reuptake Inhibitors, SSRIs)能够对神经病理性疼痛产生镇痛效果。该研究结果提示了一个治疗神经病理性疼痛的新途径。

核心观点
2、脊髓KCC2功能低下使得RMg 5-HT神经元的疼痛下行抑制转变为下行易化;KCC2增强子可恢复5-HT介导的下行抑制和镇痛;
3、结合SSRIs和KCC2增强子可以有效的缓解神经损伤引起的痛觉过敏。
研究结果分析
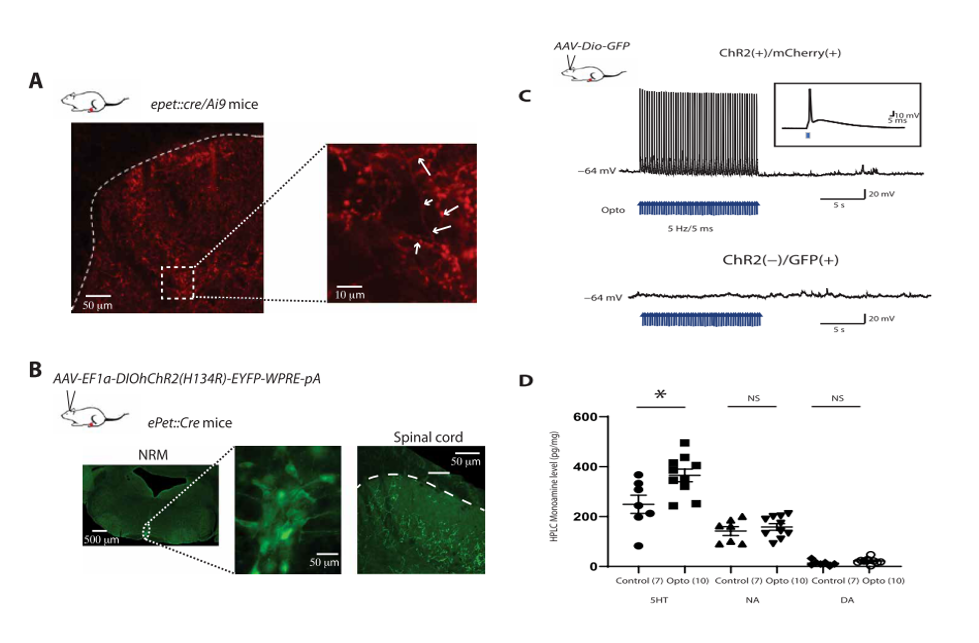
1. RMg 5-HT神经元的光遗传激活导致脊髓5-HT选择性的释放
为了明确了RMg 5-HT神经元在伤害性信号传递中的作用。作者首先通过转基因小鼠确定了5-HT神经元在DHSC的浅表和深层中存在神经投射。随后,作者通过病毒注射的方法在5-HT神经元中表达ChR2蛋白。三周后,ChR2在RMg的5-HT神经元的胞体以及DHSC的投射中都有表达。全细胞膜片钳记录显示,5-HT神经元动作电位能够忠实地被光刺激所触发。利用高效液相色谱对DHSC进行测量,作者观察到光刺激激活5-HT神经元引起了DHSC中5-HT水平的显著增加。
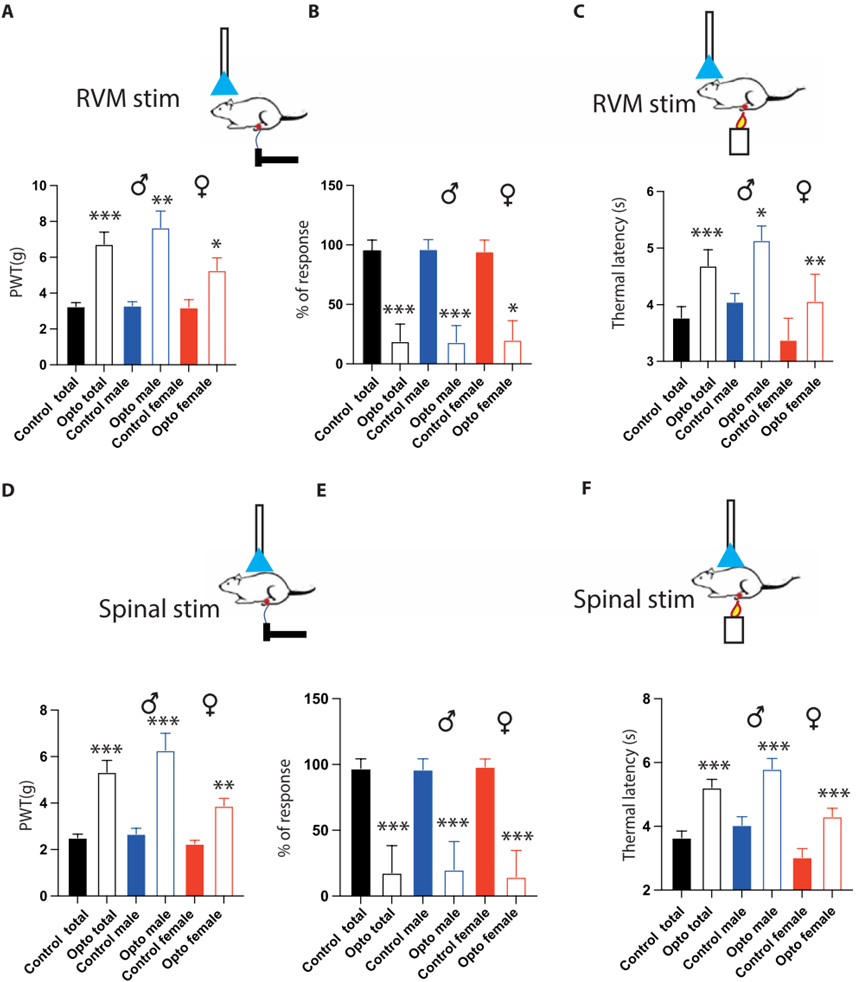
2. 脊髓中RMg 5-HT神经末梢的光遗传激活产生阵痛作用
然后,作者在注射部位上方(RMg)对5-HT神经元进行了光遗传刺激。结果显示,激活RMg 中的5-HT神经元对动物的机械痛和热痛均产生了强烈的抑制作用。为了聚焦于投射到DHSC的下行通路,作者在脊髓上方对5-HT神经末梢进行光遗传激活,观察到了与上述相同的结果,表明5-HT诱导的镇痛是由于DHSC中的5-HT神经投射激活产生的。
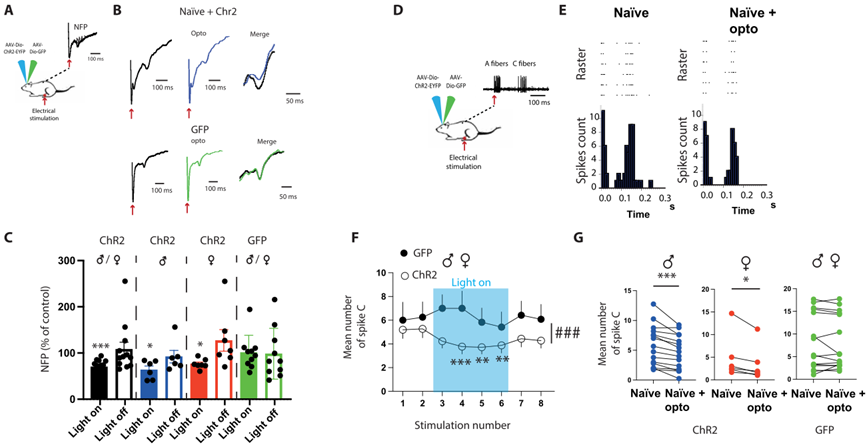
3. RMg 5-HT神经元能够抑制脊髓痛觉
为了证实这种镇痛作用是由于直接调控了DHSC中伤害性信息传递,作者进行了在体电生理记录。作者首先评估了光遗传刺激5-HT神经元的整体后果,在光遗传刺激下,小鼠的痛觉场电位(Nociceptive field potentials, NFPs)降低,这种效应在雄性和雌性中是相同的,证实了5-HT诱导的镇痛是由于改变了DHSC中的伤害感受传递。为了确定痛觉信息的减少是否局限于DHSC水平,作者记录了投射之外的DHSC深部神经元,记录限制在广动力范围神经元中(Wide Dynamic Range neurons, WDRs),这些神经元高度收敛,并表现出明显的c成分(即在相应的感受域受到超阈值电刺激后出现延迟反应,可作为痛觉传递的读出)。在光遗传刺激期间,作者观察到c-纤维范围内的动作电位数量减少,这种下降在雄性和雌性动物中一致。
4.RMg 5-HT的镇痛作用于脊髓局部GABA能/甘氨酸能神经元
随后,作者进一步确定了参与这种镇痛的脊髓微环路。通过对条件性标记5-HT纤维结合组织免疫染色,作者比较了小鼠DHSC中5-HT纤维与兴奋性(tlx3)或抑制性神经元(Pax2)标记物的位置。结果显示,在雄性和雌性中,5-HT纤维与Pax2的接触比tlx3更密切,这表明5-HT纤维与脊髓局部抑制性中间神经元之间存在联系。为了证实这一假设,作者使用GABA能神经元荧光标记的小鼠并进行TPH2免疫染色,在GABA能中间神经元的胞体和纤维上发现了5-HT+末梢。另外,作者利用病毒介导的条件表达方式,对RMg中的5-HT神经元进行标记,并在DHSC的深层中发现了突触末端。最后作者利用杂交的转基因小鼠结合病毒介导的条件表达的方式,观察到DHSC中RMg 5-HT的神经投射与GABA能神经元的胞体和纤维上形成的突触连接。
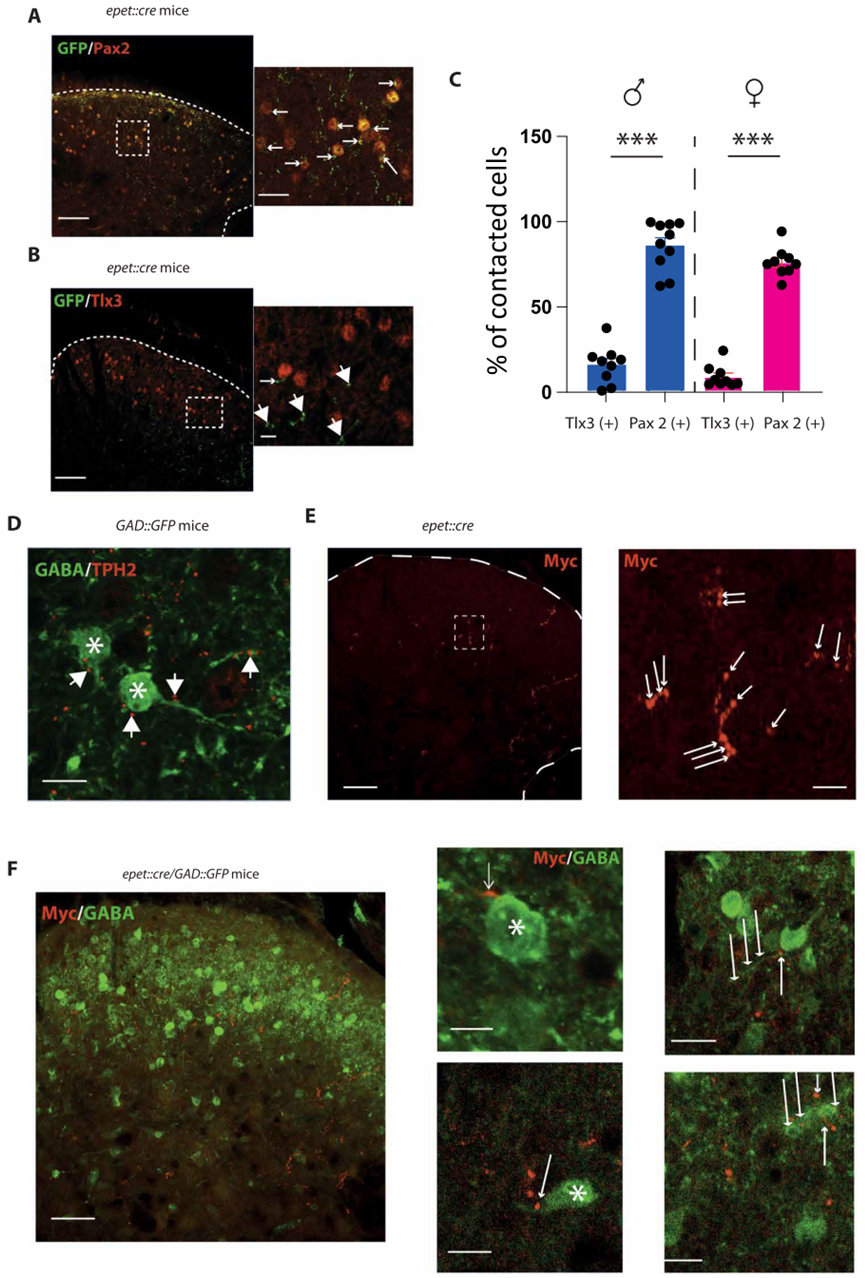
为了确定光遗传刺激是否激活DHSC中的抑制性中间神经元,作者在光遗传刺激进行了cFos/ Pax2免疫染色。结果显示,在DHSC的浅层和深层,同时含有Pax2(+)的c-Fos(+)神经元,表明光遗传激活5HT纤维激活了脊髓抑制性中间神经元。最后,为了证实这种镇痛作用是由于RMg 5-HT神经元和DHSC中抑制性中间神经元的微环路所介导,作者评估了动物在鞘内注射拮抗剂阻断GABAA和甘氨酸受体后,光遗传刺激5-HT纤维时的机械和热刺激敏感性。注射拮抗剂抑制了光遗传刺激对小鼠的镇痛作用。为了证实这种阻断改变了DHSC的伤害性信息传递,作者对WDR神经元进行了体内电生理记录,观察到阻断GABA/甘氨酸受体会抑制WDR神经元反应性的降低。这些结果表明,来源于RMg的5-HT纤维通过作用于脊髓中的抑制性中间神经元从而抑制脊髓伤害性信息传递。
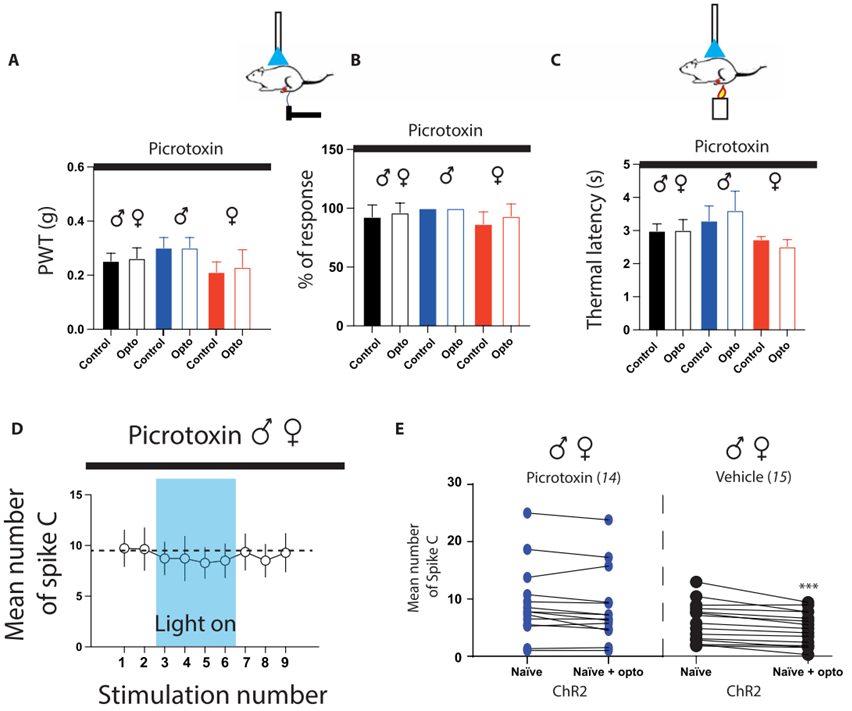
5. 阻断脊髓KCC2将RMg 5-HT的下行抑制转换成兴奋
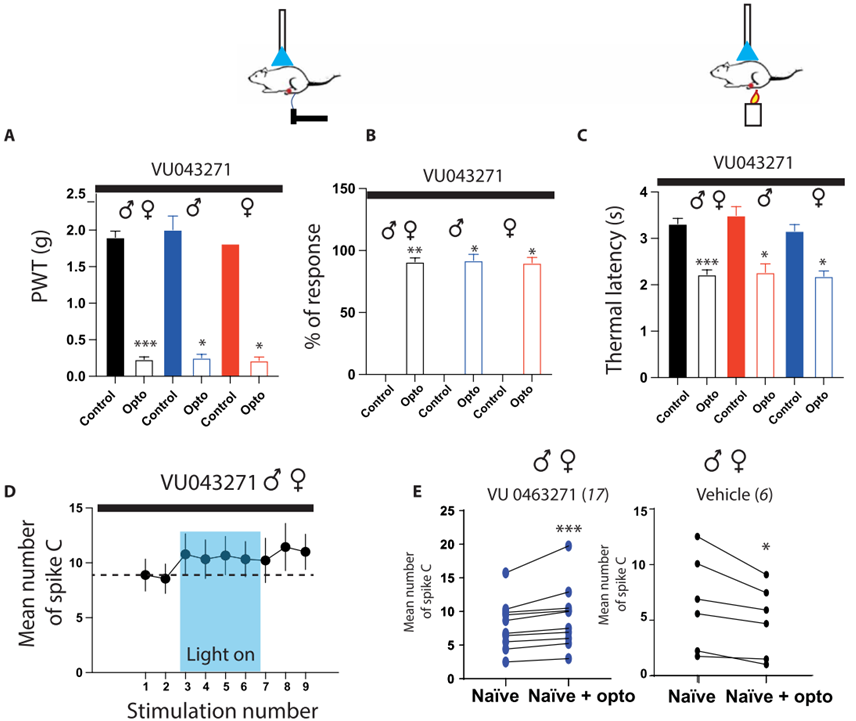
6. 神经损伤引起脊髓KCC2功能低下导致RMg 5-HT的下行抑制转换成兴奋
然后,作者使用神经病理性疼痛(SNI)小鼠模型研究了5-HT下行通路在病理背景下的作用。在SNI手术后两周,小鼠表现出强烈的机械痛和热痛超敏反应。形态学检查结果确定了SNI小鼠的5-HT下行神经投射结构并没有发生变化,其密度与突触连接与Naïve小鼠相当。在SNI小鼠中,当作者用光遗传刺激激活脊髓中的RMg 5-HT下行纤维时,小鼠机械痛和热痛超敏反应进一步增强。
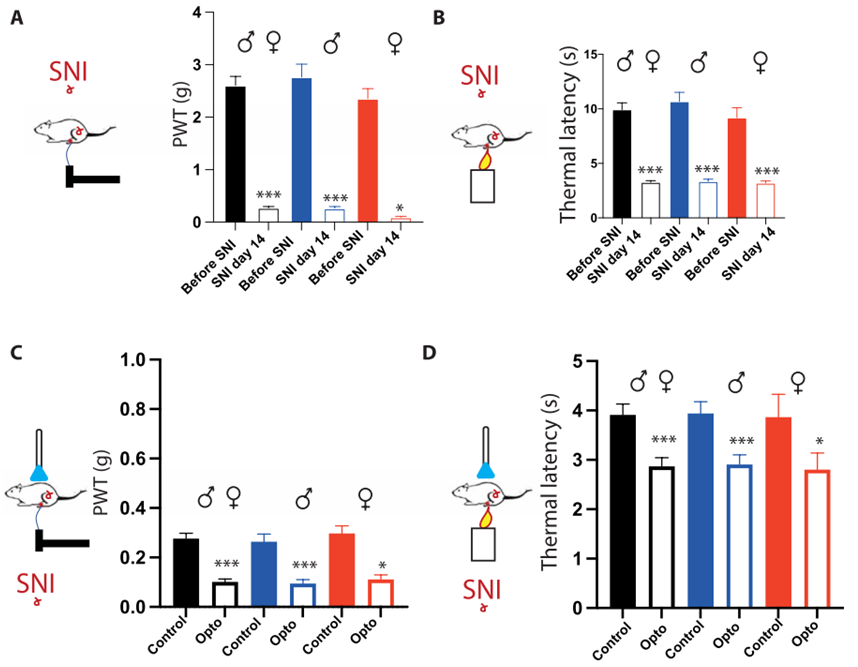
在体电生理记录表明,这些机械痛和热痛过敏反应增强与DHSC神经元的反应性增加相关,在脊髓5-HT纤维末梢的光遗传激活过程中,WDR神经元对外周刺激中c -纤维传入的反应显著增加。这些结果强烈提示,脊髓神经元氯离子失衡可能会通过将RMg 5-HT纤维的下行抑制作用转换为下行易化来改变对疼痛的控制。
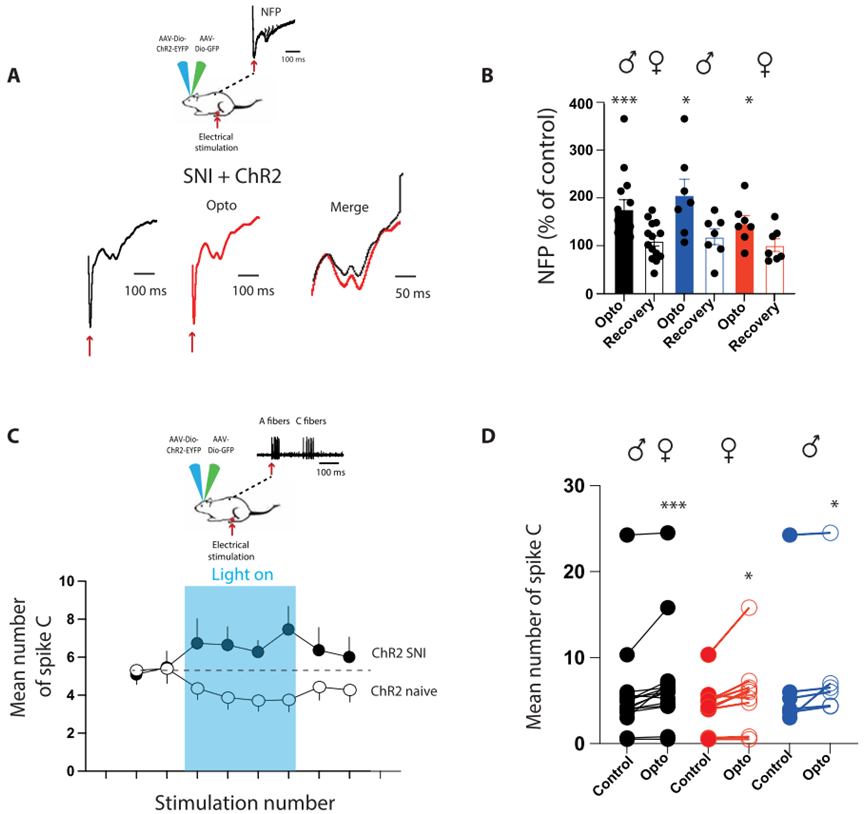
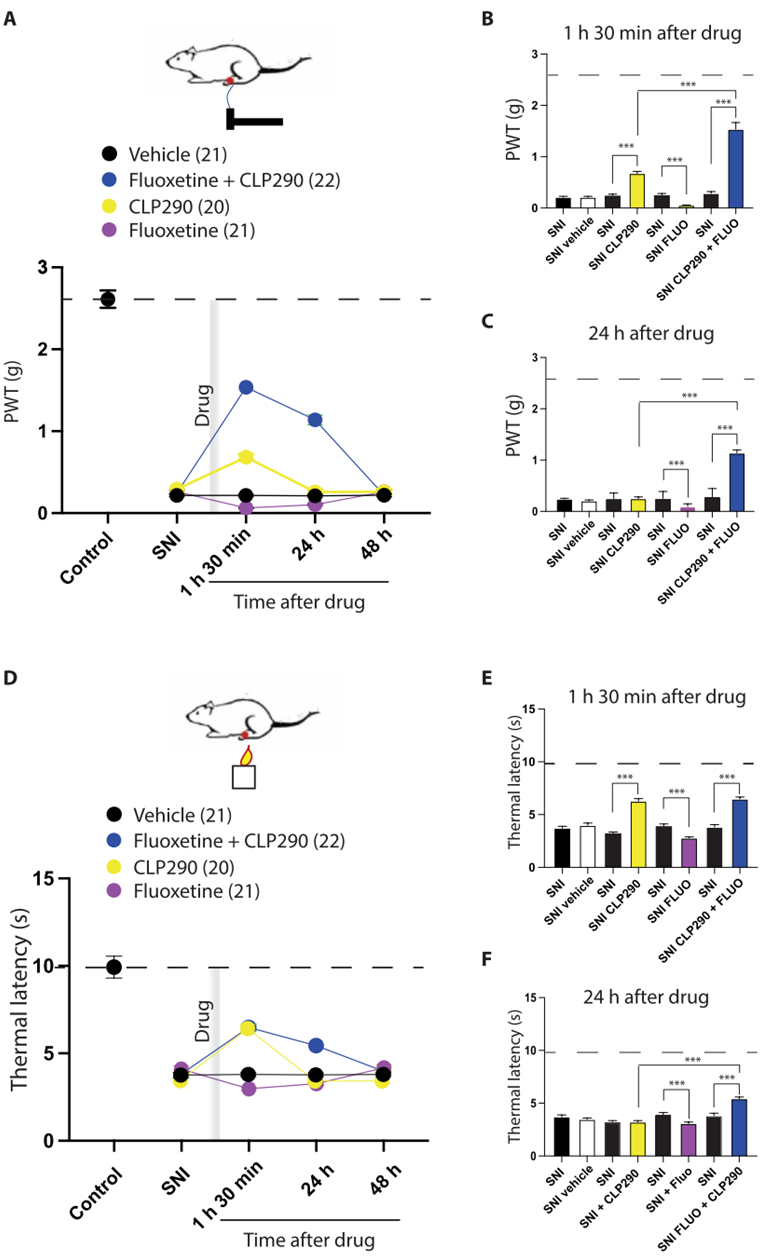
为了验证这一可能性,作者使用CLP290从药理学上增强SNI小鼠的KCC2氯转运蛋白。作者观察到CLP290能够显著诱导了DHSC神经元细胞膜上的KCC2水平增加。然后,作者评估了CLP290处理后的SNI小鼠在光遗传刺激时的疼痛行为,5-HT纤维的光遗传刺激显著缓解了SNI小鼠的机械痛和热痛过敏。利用在体电生理记录,作者还发现,在CLP290处理后,小鼠的WDR神经元在RMg 5-HT纤维的光刺激过程中对外周刺激的反应性降低。这些结果表明,KCC2介导的氯平衡能够控制RMg 5-HT的下行效应:正常的氯平衡能够有效的维持RMg 5-HT下行投射的抑制作用,而神经损伤后KCC2功能低下,引起氯平衡失调,导致RMg 5-HT的下行抑制作用转为下行易化。

7. 挽救KCC2功能恢复SSRI介导的镇痛
总结
研究方法亮点













