文献速读 | 拥抱奖赏,拒绝成瘾,奖赏与成瘾机制研究进展速读
Neuron:编码尼古丁厌恶反应的神经环路机制
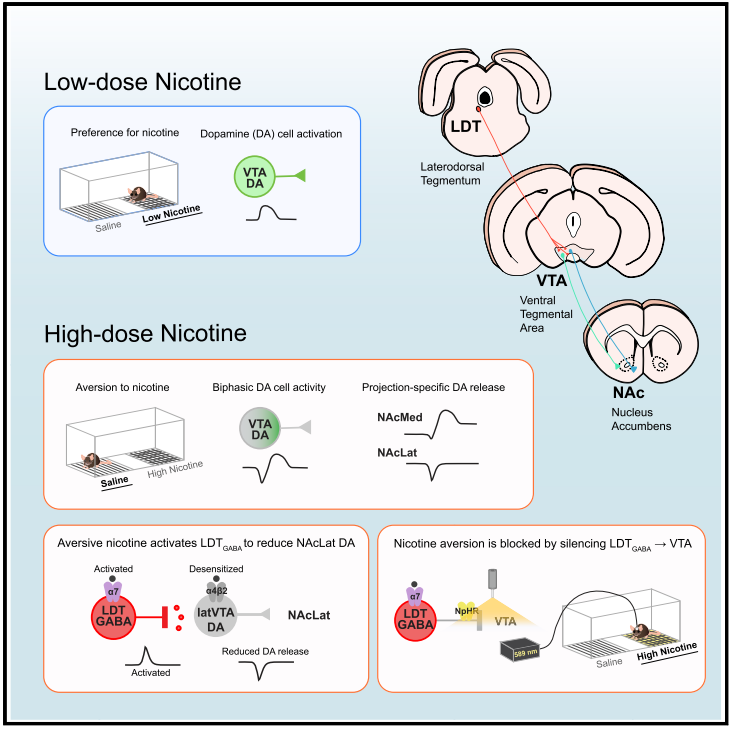
尼古丁成瘾的一个重要假设是尼古丁“劫持”了大脑中的奖赏系统。然而,动物对尼古丁的反应呈现剂量依赖性:在低剂量时,动物表现为奖赏行为,而在高剂量时,动物则会产生强烈的厌恶反应。与其它成瘾物质不同,尼古丁是唯一被观察到在啮齿类动物中能够引起厌恶反应的药物。然而,对于已知的调节奖赏和厌恶情绪的多巴胺回路是否构成了尼古丁剂量依赖效应的基础目前仍不确定。
2022年8月1日,美国加州大学欧文分校的研究人员在《Neuron》期刊上发表题为 “An inhibitory brainstem input to dopamine neurons encodes nicotine aversion”的文章。该研究揭示了多巴胺神经元的抑制性脑干输入编码尼古丁介导厌恶信息,从神经环路水平揭示了尼古丁剂量依赖性的奖赏和厌恶作用。在文章中,作者证实高剂量的尼古丁会诱导小鼠的厌恶相关行为,引起腹侧被盖区多巴胺神经元双向反应,这些神经元分别投射到伏隔核外侧和内侧亚区。尼古丁的剂量反应依赖于α4β2和α7尼古丁受体。外背侧被盖区中GABA神经元上α7受体激活是外侧伏隔核中多巴胺释放减少的关键调节因子,抑制外背侧被盖区中GABA神经元末梢可预防尼古丁厌恶反应。
该研究阐述了一个尼古丁厌恶反应神经环路,这可能是未来尼古丁成瘾治疗的有效方法。
Science Advances:D1-MSNs亚型可负向调节可卡因成瘾行为
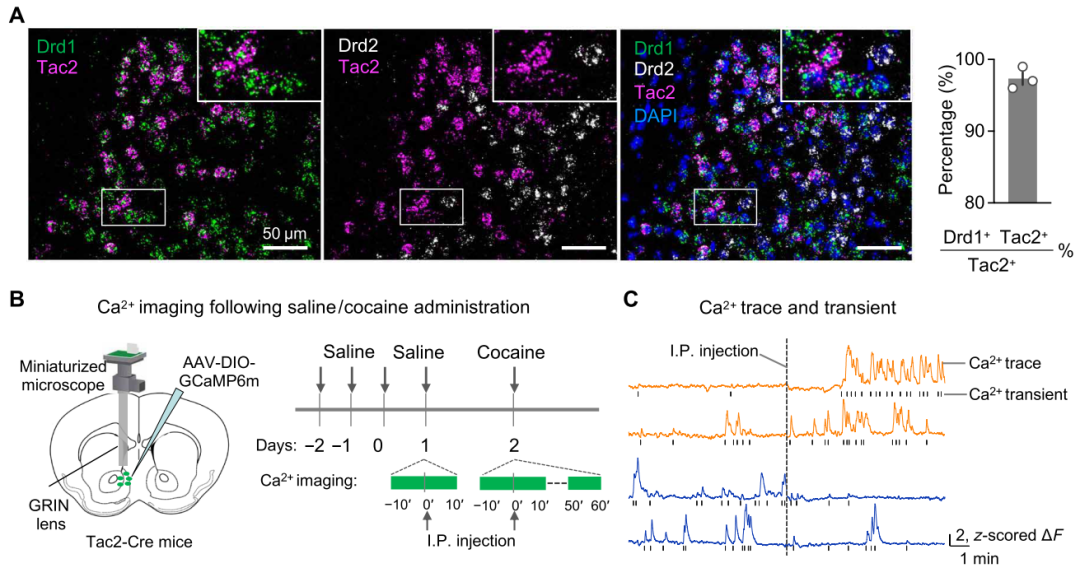
纹状体在调节成瘾相关行为中起着关键作用。传统的二分模型显示纹状体D1/D2中型多棘神经元(Medium Spiny Neurons, MSNs)能够正向/负向调节成瘾相关行为。然而,该模型并不能解释纹状体神经元的异质性和功能多样性,而且在D1/D2群体之外的MSN亚型是否在药物成瘾中发挥着独特的作用仍然是未知的。
2022年8月12日,美国波士顿儿童医院的研究人员在《Science Advances》杂志上发表题为“A molecularly defined D1 medium spiny neuron subtype negatively regulates cocaine addiction”的文章。通过使用可卡因成瘾小鼠模型,作者确定了表达速激素2(Tac2+)的D1-MSNs亚型神经元在可卡因成瘾中的作用,该亚型存在于啮齿动物和灵长类动物的纹状体中。作者发现,急性给予可卡因会降低Tac2+神经元的活性,而可卡因调节会改变与可卡因奖励相关的神经元反应。此外,Tac2+神经元的激活/抑制可减弱/促进可卡因诱导的条件性位置偏好和可卡因静脉注射自主给药。此外,刺激伏隔核-下丘脑外侧环路中的Tac2+神经元的可抑制可卡因奖励行为。
该研究揭示了D1-MSNs在药物成瘾中的非常规负调控功能,该功能以细胞亚型和投射特异性的方式运作。
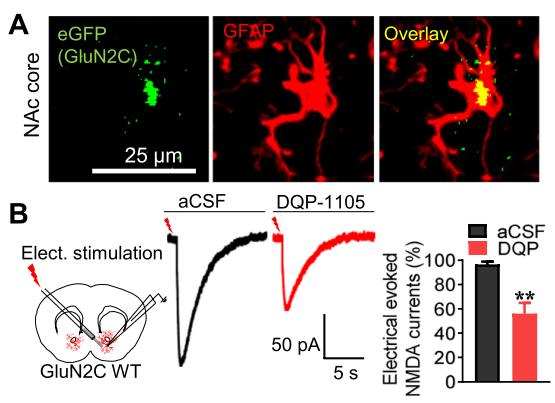
Science Advances:星形胶质细胞NMDA受体可维持可卡因记忆
从奖赏到成瘾是一个多层面和相互关联的行为序列,涉及大脑多个区域、不同细胞类型以及信号通路。最近的研究表明,星形胶质细胞参与突触传递、突触可塑性、突触形成、维持和消除,并且在奖赏行为中的神经可塑性中也发挥了作用。此外,星形胶质细胞也表达n -甲基- d -天冬氨酸(N-methyl- d -aspartate, NMDA)受体,但其在成瘾行为中的作用尚不清楚。
2022年7月22日,美国克莱顿大学的研究人员在《Science Advances》杂志上发表题为“Cocaine preference and neuroadaptations are maintained by astrocytic NMDA receptors in the nucleus accumbens”的文章,该研究探讨了星形胶质细胞NMDA受体在药物诱导的行为和可塑性中的潜在作用。作者发现,星形胶质细胞的NMDA受体是维持可卡因偏好记忆的关键,清除伏隔核星形胶质细胞的NMDA受体有助于消除可卡因诱导的条件性位置偏好。此外,作者发现伏隔核星形胶质细胞NMDA受体由GluN2C亚基组成,可卡因会增加GluN2C的表达,这对可卡因记忆的维持至关重要,GluN2C敲除小鼠的可卡因记忆消退增强证明了这一点。此外,星形胶质细胞NMDA受体和GluN2C亚基通过调节突触源性因子的表达,在可卡因诱导的树突棘和突触可塑性中起关键作用。
总之,这些结果确定了一种以前未知的星形胶质细胞NMDA受体机制,该机制可以维持可卡因的记忆。
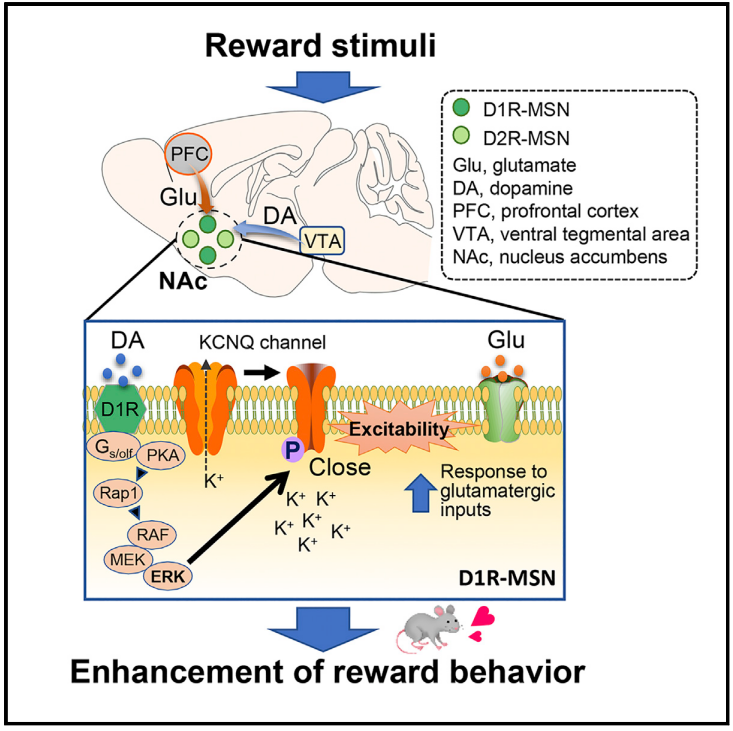
Cell Reports:多巴胺通过KCNQ通道磷酸化来驱动奖赏行为
多巴胺神经元能够调节记忆和学习、运动功能、以及动机和奖励的情绪行为。功能失调的多巴胺信号涉及各种神经心理障碍,包括帕金森病、药物成瘾和精神分裂症等。纹状体/伏隔核中表达多巴胺D1受体(D1R)的中型多棘神经元(Medium Spiny Neurons, MSNs)受多巴胺和谷氨酸的双重控制,在奖赏行为中起着关键作用。多巴胺似乎增加了D1R-MSNs的兴奋性,进而促进谷氨酸诱导的放电,并导致奖励行为。然而,多巴胺促进MSN兴奋能力的分子机制仍有待研究。
2022年9月6日,日本藤田保健卫生大学的研究人员在《Cell Reports》杂志上发表题为“Dopamine drives neuronal excitability via KCNQ channel phosphorylation for reward behavior”的文章。该研究证实,D1R激动剂SKF81297抑制KCNQ介导的电流,并增加小鼠伏隔核切片中D1R-MSNs的放电频率,而这一现象被ERK信号抑制所消除。激活D1R/PKA/ERK信号通路增加了KCNQ2的磷酸化。D1R-MSNs中条件缺失KCNQ2可降低SKF81297对KCNQ通道活性的抑制作用,同时增强神经元兴奋性和可卡因诱导的奖励行为。这些效应可在野生型而非KCNQ2磷酸化缺失的表型中得到恢复。因此,D1R-ERK信号可以通过KCNQ2磷酸化来控制MSNs的兴奋性,从而调节奖赏行为。
这些结果提示KCNQ2可以作为奖赏环路失调相关精神疾病的潜在治疗靶点。