山东大学齐鲁医院薛皓、李刚团队为胶质母细胞瘤放射治疗后脑损伤的修复提供新思路
胶质母细胞瘤(GBM)是中枢神经系统最恶性的脑肿瘤之一,且预后较差。GBM的标准治疗措施包括手术和替莫唑胺同步放疗。放射治疗使患者暴露于受控水平的电离辐射(IR),是GBM患者治疗的重要组成部分。然而,高剂量的超电压辐射通常会导致不可逆转的脑损伤。研究表明,大约50 - 90%的幸存者可能表现出认知功能障碍。放射性脑损伤(RIBI)是颅脑放疗最常见的并发症,其发病机制尚未阐明。尽管同时进行放化疗,GBM患者的中位生存期仅为14个月,大多数患者最终死于肿瘤复发。因此,开发一种既能同时杀死肿瘤又能在放疗后起到神经元保护作用的药物就显得尤为重要。

2024年7月17日,山东大学齐鲁医院脑与类脑科学研究院薛皓、李刚团队在ACS Nano上发表题为“Cerium Vanadate Nanozyme with pH-Dependent Dual Enzymatic Activity for Glioblastoma Targeted Therapy and Postradiotherapy Damage Protection”的研究论文。文章报道,作者合成了一种用于胶质母细胞瘤(GBM)治疗和GBM电离辐射(IR)后脑损伤修复的仿生平移型钒酸铈(CeVO4)纳米酶,该系统表现出pH依赖性:在中性环境下表现出强大的超氧化物歧化酶(SOD)酶活性,在酸性环境下表现出强大的过氧化物酶(POD)酶活性。在GBM细胞中,该系统作用于溶酶体,导致细胞损伤和活性氧(ROS)积累;在神经元细胞中,该纳米酶可以通过溶酶体逃逸和纳米酶与线粒体聚集,逆转IR引起的线粒体损伤,恢复抗凋亡BCL-2蛋白的表达水平。在机制上,我们认为这种分布差异与神经元中特定的摄取内化机制和溶酶体修复途径有关,最终导致体内模型中肿瘤杀伤和神经修复的双重作用。
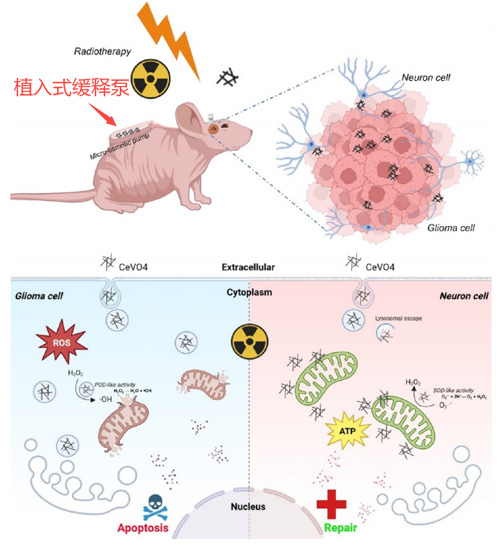
图1. CeVO4催化-治疗原理图,在电离辐射(IR)的作用下,局部注射CeVO4表现出pH依赖性实现对胶质瘤细胞的靶向杀伤和神经元的保护
作者建立了一个GBM放射治疗同时瘤内给药CeVO4的模型,用于体内评估。具体来说,将荧光素酶标记的LN229 GBM细胞原位植入免疫缺陷裸鼠的大脑(第7天)。肿瘤起始7天后,将裸鼠随机分为4组,这四组分别是生理盐水注射组、CeVO4注射组、IR组(4*3.5 Gy)和IR + CeVO4注射组。所有连续注射实验,均在瑞沃德1002W植入式缓释泵和Bic-3脑输注配件包辅助下进行。
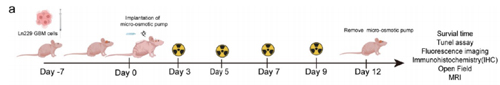
图2. 动物实验时间表及示意图
研究发现第18天的生物发光图像显示,IR + CeVO4组的肿瘤抑制效果最强,Kaplan - Meier存活曲线显示,IR + CeVO4组裸鼠存活时间最长,苏木精和伊红(H&E)染色显示,IR + CeVO4组肿瘤组织最小。还通过免疫组化方法验证了BLC2蛋白在肿瘤组织中的表达,结果显示IR组BCL2表达最低,IR + CeVO4组可减轻IR所致的神经元损伤。这些结果表明,CeVO4应用于同步放疗可能是杀死GBM细胞和治疗IR后脑损伤患者的一种可能手段。
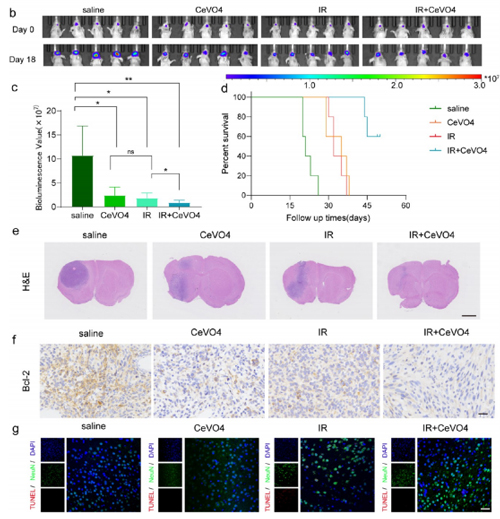
图3. CeVO4抗肿瘤及神经元保护作用的体内评价
矿场实验用于测量探索性运动活动,先前的研究表明,动物在开放场地可能表现出活动减少、正常活动或过度活动,这取决于脑损伤的严重程度和形式。在IR组中,由于RIBI的发生,小鼠的探索能力降低,大部分时间都蜷缩在周围区域然而,在IR + CeVO4组中,小鼠进入中心区的数量明显增加,在中心区停留的时间也明显延长。在生理盐水组、CeVO4组和IR组中我们可以看到肿瘤区域伴有中线的轻微移位。有趣的是,CeVO4联合使用后,水肿消失,肿瘤缩小明显。这也为动物行为学的改善提供了有益的证据。
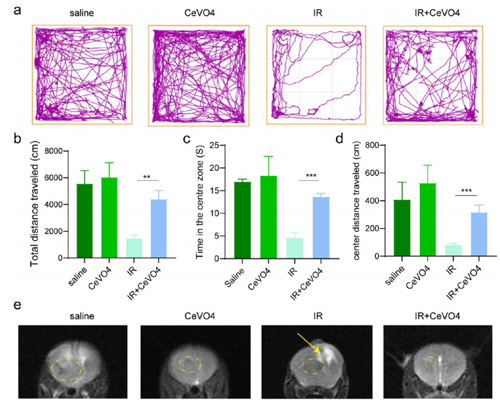
图4. CeVO4抗肿瘤及神经元保护作用的体内评价
研究方法亮点
该工作合成了一种具有双纳米酶活性的CeVO4纳米酶。在中性pH条件下,这些纳米酶表现出类似sod的酶活性,能够清除O2·—;在酸性条件下,它们表现出类pod酶的活性,能够产生·OH。与异常增殖细胞(GBM细胞)相比,这些不同的酶功能可以在正常细胞(神经元细胞)中发现。在GBM细胞中,CeVO4以溶酶体为靶点,在溶酶体的酸性环境中表现出POD酶活性,杀死肿瘤细胞。在神经元细胞中,CeVO4通过溶酶体逃逸并定位于线粒体,发挥SOD酶活性,从而挽救了IR引起的线粒体损伤。溶酶体修复功能在这一过程中起着至关重要的作用。相关研究为辐射性脑损伤的治疗提供了一种范式,并为CeVO4纳米酶的应用提供了思路。研究人员使用了瑞沃德1002W植入式缓释泵和Bic-3脑输注配件包,为实验的顺利开展提供了支持。此外,瑞沃德还可提供该研究所涉及神经科学研究的完整解决方案、动物给药与采样解决方案。
截止目前,瑞沃德产品及服务覆盖海内外100多个国家和地区,客户涵盖全球2500+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。