揭开大脑中控制饥饿与饱足的神秘神经元
我们的饮食行为背后有一个关键的“幕后操控者”——瘦素(Leptin)。早在1994年,洛克菲勒大学的Jeffrey Friedman博士首次发现了这种由脂肪细胞分泌的激素。瘦素通过作用于大脑来调节体重,其水平与体脂量成正比。当脂肪增加时,瘦素水平上升,向大脑发出“停止进食”的信号;而当脂肪减少时,瘦素水平下降,刺激大脑“赶紧吃点东西吧”。这一动态反馈机制帮助我们在饥饿与饱足之间保持平衡,就像一盏信号灯,指引着身体的能量调节。
近日,洛克菲勒大学Jeffrey Friedman博士团队在《Nature》上发表了一篇题为“Leptin-activated hypothalamic BNC2 neurons acutely suppress food intake”的研究论文,第一作者为谭晗博士。该研究首次揭示了一种新型的能够快速调节食欲的神经元——BNC2神经元。这一发现不仅为瘦素调控食欲和代谢的新模型提供了有力证据,也重新定义了大脑中饥饿与饱足的“阴阳”调节机制,为未来肥胖和代谢疾病的治疗提供了潜在的新靶点。

瘦素与饥饿调节的“阴阳平衡”
瘦素通过作用于大脑中表达瘦素受体(leptin receptor, LepR)的神经元来调节体内平衡。这些神经元被称为一级神经元,在接收到瘦素信号后,会将信息传递给下游神经元,从而调控食欲、能量消耗等生理功能。
在大脑中,瘦素受体(LepR)神经元主要集中于下丘脑弓状核(arcuate nucleus of the hypothalamus, ARC),其中最著名的两类是:
1、AGRP神经元:在进食不足、瘦素水平下降时被激活,负责促进饥饿,从而刺激食欲。
2、POMC神经元:在进食足够、瘦素水平上升时被激活,负责抑制饥饿,传递饱足信号。
这两类神经元共同构成了瘦素调控食欲的核心机制,被描述为“阴阳平衡”模式:AGRP神经元代表“阴”,引发饥饿;POMC神经元代表“阳”,产生饱足感。这种平衡对维持体重和能量代谢至关重要。
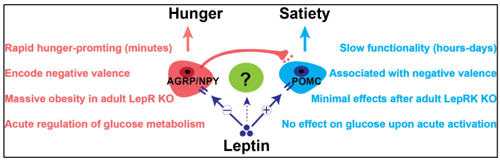
瘦素调控模型的不完美
尽管AGRP和POMC神经元是瘦素调控食欲的核心,但这一“阴阳平衡”模型并不完美,研究揭示了其局限性:
- 快速性差异:激活AGRP神经元时,动物会在几分钟内迅速开始进食。相比之下,激活POMC神经元并不能立即抑制食欲,需要持续8-12小时才能显著减少进食,显示POMC神经元的短期效应较弱,难以快速对抗AGRP神经元的饥饿信号。
- 情绪效应:AGRP神经元的激活伴随着强烈的饥饿不适感,而POMC神经元的激活则未带来显著的正面情绪,甚至可能伴有一些轻微的负面情绪。
- 功能不对称:在成年动物中删除AGRP神经元的瘦素受体会导致过度进食和肥胖;而删除POMC神经元的瘦素受体对食欲和体重几乎没有影响,表明POMC神经元在瘦素信号调节中的作用有限。
- 血糖调节差异:AGRP神经元的快速激活不仅会引发进食,还能独立调节血糖,引起胰岛素耐受;而POMC神经元的快速激活对血糖浓度却没有显著影响。这一差异进一步揭示了两类神经元在代谢功能上的不对称性。
这些现象表明,POMC神经元并不是AGRP神经元的理想对手。这也暗示了可能存在一种尚未识别的神经元,能够在短时间内快速抑制饥饿,并同时调节血糖,实现更全面的代谢平衡。
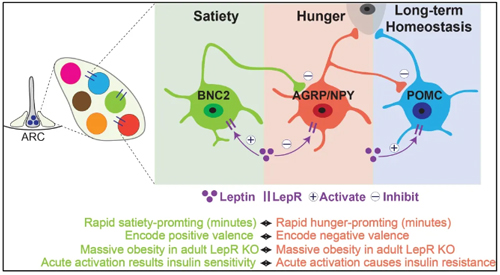
BNC2神经元:瘦素调控中的“新角色”
为了解决这一谜团,研究团队采用了单细胞RNA测序(snRNA-seq)和流式细胞术等技术,对下丘脑弓状核的神经元进行了全面分析,识别出21种不同的神经元群体。其中,有三种表达LepR的神经元,即AGRP神经元、POMC神经元,以及一种因独特表达BNC2(Basonuclin2)基因的新型LepR神经元,被命名为BNC2神经元。
实验显示,BNC2神经元在进食和瘦素的刺激下被激活。通过光遗传学和化学遗传学手段,研究人员发现激活BNC2神经元可以迅速抑制食欲,而抑制它们则会增加食欲和体重。更有趣的是,BNC2神经元能够直接抑制AGRP神经元的活动,缓解饥饿引发的负面情绪,并带来正面情绪反应,与AGRP神经元的效果形成鲜明对比。
BNC2神经元的更多功能:调节血糖与肥胖
除了控制食欲外,BNC2神经元还具有调节血糖的功能。激活这些神经元能降低血糖水平、提高胰岛素敏感性,这与AGRP神经元的作用完全相反。此外,在成年小鼠中删除BNC2神经元的瘦素受体,会导致类似AGRP神经元的过度进食和肥胖。
重塑瘦素调控的“阴阳平衡”
这项研究揭示了BNC2神经元作为瘦素调控食欲和代谢的“新角色”,为理解饥饿与饱足的调节机制提供了全新的视角,并为瘦素调控的新模型提供了有力证据。BNC2神经元与AGRP神经元相互对抗,共同维持食欲和体重的平衡,重新定义了瘦素在大脑中的“阴阳”调节机制。这一成果不仅深化了我们对瘦素作用的认识,也为肥胖和代谢疾病的治疗提供了潜在的新靶点。
该研究得到了纽约大学林大宇博士团队的尹璐萍博士(现为西湖大学助理教授)、斯坦福大学谭玉琪博士等的大力协助。
文章作者包括:Han L. Tan (谭晗), Luping Yin (尹璐萍), Yuqi Tan (谭玉琪), Jessica Ivanov, Kaja Plucinska, Anoj Ilanges, Brian R. Herb, Putianqi Wang (王浦天琦), Christin Kosse, Paul Cohen, Dayu Lin(林大宇), Jeffrey M. Friedman.
DOI:10.1038/s41586-024-08108-2
作者介绍

谭晗博士现为洛克菲勒大学Jeffrey Friedman实验室的博士后研究员。本科毕业于北京大学医学部基础医学专业,期间师从王韵教授,专注于研究辣椒素在脑缺血中的神经保护作用。在博士阶段,谭博士在约翰霍普金斯大学(Johns Hopkins University)跟随Richard Huganir教授进行研究,主要聚焦于大脑功能和疾病的细胞与分子机制,特别是AMPAR的调控性运输。他对自闭症相关基因GRIP1进行了深入研究,揭示了其在突触可塑性、学习、记忆中的关键作用及其在自闭症中的潜在影响(Tan et al., PNAS. 2015; Tan et al., PNAS. 2020)。此外,他还利用双光子活体成像技术,研究了AMPAR在清醒小鼠大脑中的动态变化(Tan et al., eLife. 2020; Graves*, Roth*, Tan* et al., eLife. 2021)。
博士毕业后,谭博士加入了Jeffrey Friedman实验室,专注于能量平衡和肥胖的细胞与分子机制,特别是瘦素在调控食欲和代谢中的作用。他在研究中发现了一类新型的BNC2瘦素受体(LepR)神经元,能够快速抑制食欲,为调节饥饿与饱足的神经机制提供了全新的视角(Tan et al., Nature 2024)。