尼莫地平“老药新用”:钙离子通道阻断剂靶向周细胞“弯道超车”,提高AD患者认知能力的新策略
阿尔茨海默病(AD)是一种常见的神经退行性疾病,其特征性病理改变是脑内β-淀粉样蛋白(β-amyloid,Aβ)沉积,导致患者认知功能逐渐下降。近年来的研究表明,在AD早期,脑血流(CBF)就已经出现下降,这种下降与认知功能的减退密切相关。
CBF的降低可能导致颅内缺氧和营养供应不足,进而影响神经元的正常生理功能。血管周细胞(pericytes)是包裹在脑毛细血管周围的特殊细胞,它们通过调节血管的收缩和舒张来控制CBF。在AD模型中,血管周细胞的异常收缩导致毛细血管血流阻力增加,CBF下降。这一“周细胞-脑血流-认知功能”轴的反馈机制提示我们周细胞的关键作用,因此,探索调节血管周细胞收缩的机制,寻找有效改善CBF的策略,对于AD的治疗具有重要的理论和实践意义。
近日,英国伦敦大学学院David Attwell 院士等研究学者在国际著名期刊 Nature Neuroscience (IF=21.2)上发表题为 Inhibiting Ca2+ channels in Alzheimer’s disease model mice relaxes pericytes, improves cerebral blood flow and reduces immune cell stalling and hypoxia 的研究文章。作者结合激光散斑血流成像、双光子成像和磁共振成像等技术,揭示了L型电压门控钙通道(CaVs)在血管周细胞收缩中的关键作用。研究进一步阐明了阿尔茨海默病(AD)模型小鼠中血管周细胞收缩的调控机制,并探讨了钙离子通道阻断剂尼莫地平(Nimodipine)对血管周细胞收缩和脑血流(CBF)的影响。该研究不仅为改善AD患者的认知功能提供了新策略,还通过明确尼莫地平“老药新用”的作用机制,为未来AD治疗开辟了潜在的新靶点。

在野生型小鼠体内,CaVs为周细胞赋予肌源性张力
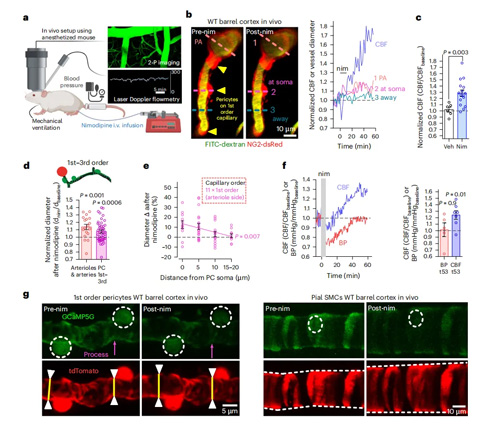
为了评估CaVs是否在体内产生收缩张力,研究使用活体双光子成像技术测量了NG2-dsRed小鼠中的CBF,通过静脉注射尼莫地平后发现小鼠CBF持续增加,这意味着是尼莫地平提高了CBF,且尼莫地平引起的CBF增加与1至3级毛细血管直径的长期增加一致。尼莫地平引起的毛细血管扩张在血管周细胞体附近最大,并且随着距离的增加而显著减小,这与血管周细胞介导的尼莫地平引起的毛细血管扩张一致。静脉注射尼莫地平后监测脑血流和血压,数据表明,尼莫地平引起的局部血管阻力下降大于其对全身血压的下降。实验还证实了尼莫地平引起的血管壁细胞内钙离子浓度下降先于CBF的增加,并与血管舒张有关。因此,CaVs在SMCs和1至3级分支顺序的血管周细胞中赋予了肌源性张力,这为理解CaVs在体内调控血管张力的作用提供了直接证据。
CaVs增强AD小鼠毛细血管床周细胞的收缩
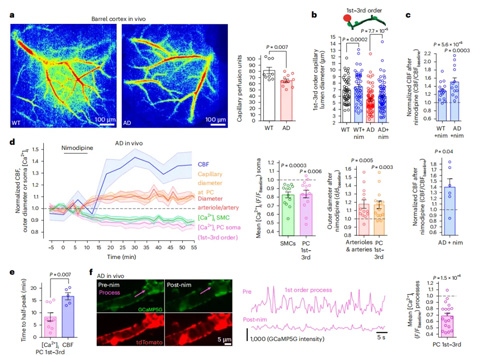
CBF在人类AD中早期下降,与周细胞收缩毛细血管相一致。研究者使用瑞沃德激光散斑血流成像系统发现,与WT小鼠相比AD小鼠的桶状皮质的毛细血管灌注显著减少。对AD小鼠的1-3级毛细血管进行体内双光子成像,发现经尼莫地平处理后AD小鼠毛细血管直径增加,CBF提高。研究者继续在AD小鼠中结合激光多普勒血流测量,发现尼莫地平显著降低了AD小鼠1-3级毛细血管周细胞过程中的平均[Ca2+]内流。在AD小鼠1-3级毛细血管周细胞中,尼莫地平治疗可大幅恢复这些细胞的钙离子瞬变频率至WT水平,并减少瞬变幅度。结合后续研究表明AD小鼠中CaVs诱发的张力更大。因此,通过使用尼莫地平阻断CaVs,可以在早期AD小鼠中逆转CBF下降,为AD的早期干预提供了潜在的治疗策略。
免疫细胞ROS提高AD小鼠的Ca2+水平,并降低CBF
为了探清免疫细胞与血管周细胞之间的互作关系,研究人员通过活体双光子成像技术观察到,在外源性给予过氧化氢(H2O2)以产生氧化应激时,血管周细胞的钙离子浓度显著上升,钙通道阻断剂尼莫地平可以减轻此现象。此外,利用抗氧化剂N-乙酰半胱氨酸(NAC)处理AD小鼠,以及活体成像技术等实验,揭示了在AD小鼠中免疫细胞与血管周细胞之间的相互作用,以及这种相互作用如何通过影响钙离子浓度来调节脑血流,为未来AD的潜在治疗策略提供了新的见解。
静脉端周细胞介导AD小鼠白细胞停滞
接下来研究者通过活体双光子成像技术,观察到AD小鼠的毛细血管阻塞百分比增加。研究人员还发现,循环中的单核细胞和中性粒细胞聚集到AD大脑中,并在毛细血管中引起阻塞。使用尼莫地平处理后,AD小鼠的毛细血管灌注大部分恢复,停滞的白细胞和红细胞数量减少到低于WT小鼠的水平。这些结果揭示了尼莫地平可能通过改善血管周细胞功能和减轻炎症反应来提高AD小鼠的CBF,为AD的潜在治疗提供了新的见解。
尼莫地平减少Aβ诱发的人脑组织周细胞收缩
尼莫地平在AD早期治疗中可能通过降低血管周细胞内的钙离子浓度,增加毛细血管直径,减少血液停滞和缺氧细胞数量而发挥保护作用,基于这调节机制,于是使用活体双光子成像技术结合非侵入性动脉自旋标记(ASL)MRI技术深入研究,发现长期尼莫地平治疗显著增加了AD小鼠的丘脑CBF。为了测试CaVs是否有助于Aβ诱发的人类周细胞收缩,研究者将存活的人皮质组织单独与人工脑脊液(aCSF)及有无尼莫地平的情况下与可溶性Aβ低聚物共孵育,揭示了在活的人脑组织中,Aβ诱发的周细胞收缩是由l型cav的激活驱动的,这可能是在人类周细胞中表达的CaV1.2亚型。因此,在AD患者中,尼莫地平有望增加毛细血管直径和减少缺氧,如在小鼠模型中观察到的那样。
研究方法亮点
1、本研究强调了血管周细胞在神经退行性疾病中的作用,并指出了L型钙离子通道 (CaVs) 作为治疗AD的潜在靶点。
2、研究表明,通过降低血管周细胞内的钙离子浓度,可以减少血管周细胞的收缩,从而为开发新的药物提供了可能的分子机制。
3、未来的研究可以进一步探索尼莫地平或其他CaVs阻断剂在临床上的应用,以及它们对AD病程的长期影响,为AD治疗提供更有效的策略。
研究人员在实验中使用了瑞沃德激光散斑血流成像系统,为实验的顺利开展提供了重要支持。此外,瑞沃德还能够提供与本研究相关的活体成像和微循环研究的完整解决方案。截至目前,瑞沃德激光散斑血流成像系统已助力客户在 Nature、Science 等顶级期刊发表超过300篇学术论文。瑞沃德的产品与服务覆盖全球100多个国家和地区,服务对象包括2500多家医院、1000多家科研机构以及6000多所高等院校,已协助全球科研人员发表SCI论文超14,500篇,广受行业认可与信赖。