微量给药套管助力发表高分文献合集
微量给药套管又称脑立体定位仪埋植管,通过脑立体定位手术将定制的导管埋植到动物的目标脑区,通过连接注射器可实现对特定脑区的反复定量给药。产品多种规格适用于单侧或双侧给药,一次埋植实现多次给药,减小由多次手术带来的动物脑部损伤。
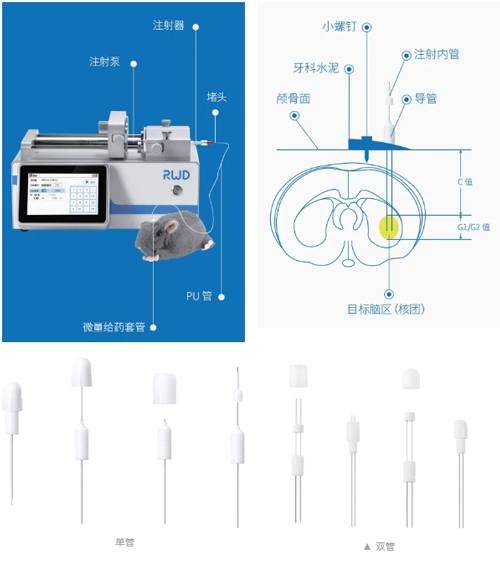
截至2024年4月,瑞沃德微量给药套管已助力发表文献超过500篇。
我们整理了一份高分文献合集,包含5篇发表在不同期刊的文章,这些文章均使用瑞沃德微量给药套管得到了理想的实验结果。
01

内容简介
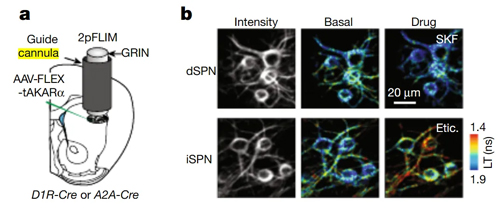
两种类型的多棘投射神经元 (dSPN 和 iSPN)中的蛋白激酶 A(PKA) 活性对于正常运动至关重要。dSPN 和 iSPN 之间不平衡可能导致运动障碍。急性腺苷积累与多巴胺释放相互作用,协调 SPN 中的 PKA 活性和动物运动过程中的适当纹状体功能。
研究直接检测了运动过程中体内 SPN 的 PKA 活性。多巴胺激活了 dSPN 中的 PKA,而iSPN 中的 PKA 活性表现出更大的增加。腺苷在运动过程中急剧积累。当腺苷 A2A 受体被阻断时,iSPNs PKA 活性的增加在很大程度上被消除。因此腺苷是参与此过程的另一种神经调节剂。
急性腺苷积累与多巴胺释放相互作用,协调 SPN 中的 PKA 活性和动物运动过程中的适当纹状体功能。了解多巴胺和腺苷在 PKA 调节中的相互作用,可能会为治疗运动相关疾病开辟新途径。
套管应用场景
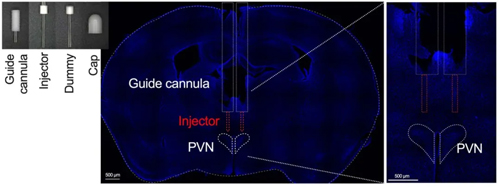
在特定脑区预先埋置给药套管(图a - cannula)以满足同时成像和局部用药,以 0.1 μl/min 的速率连续注入药物。通过紧邻引导插管植入的输注插管注射时长超过10 分钟。在局部输注之前和之后20分钟对动物进行强制运动。然后通过比较两种不同条件下运动诱导的 PKA 活性来确定局部输注药物的效果。
02

内容简介
单次全身注射后,氯胺酮持续抑制爆发放电并阻断外侧缰核 (LHb) 中的 NMDAR 长达 24 小时。NMDAR 的这种长期抑制并非由于内吞作用,而是取决于 NMDAR 中氯胺酮的使用依赖性捕获。通过激活 LHb 并在不同血浆氯胺酮浓度下打开局部 NMDAR,利用氯胺酮与 NMDAR 相互作用的动态平衡,能够缩短或延长氯胺酮体内的抗抑郁作用。
套管应用场景
小鼠双侧LHb脑区埋置给药套管(图d),每侧以每 2.5 分钟 0.1 μl速率注射1 微升Ketamine 或 memantine药物。在药物输注后24小时、7天或14天对小鼠进行行为测试。
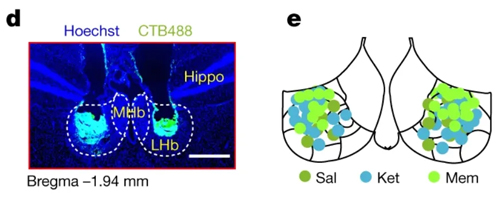
03

内容简介
微生物组调节小鼠特定大脑区域的神经元活动,以调节典型的应激反应和社会行为。通过微生物组分析和体内选择,研究人员鉴定出粪肠球菌促进社交活动并降低社交压力后小鼠的皮质酮水平。本研究表明特定的肠道细菌可以抑制下丘脑-垂体-肾上腺(HPA)轴的激活,微生物组可以通过介导大脑应激反应的离散神经元回路影响社会行为。
套管应用场景
在ABX hM4Di 和 mCherry 小鼠不同脑区预先埋置给药套管。将微量给药套管植入 PVN 脑区以输送 VEH 或 CRF,比较小鼠的非社交活动。在 DG 和 BNST 脑区注射VEH、CORT 或 DEX(图r - s)。
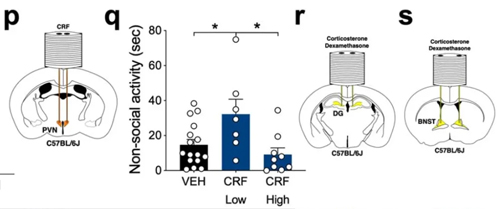
04

内容简介
在唐氏综合症背景下,人血浆中的β2-微球蛋白(B2M)升高,损害认知和突触功能,B2M 的外周耗竭可改善突触缺陷。文章证明B2M通过与 GluN1-S2 环相互作用拮抗NMDA受体功能,使用竞争性肽阻断 B2M-NMDAR 相互作用可恢复 NMDAR 依赖性突触功能。通过阻断 B2M-NMDAR 相互作用可纠正突触缺陷。证明 B2M 是一种内源性 NMDAR 拮抗剂,揭示了循环 B2M 在唐氏综合症和相关认知障碍的 NMDAR 功能障碍中的病理生理学作用。
套管应用场景
小鼠双侧海马CA1脑区埋置微量给药套管(图A),并注射入兔抗B2M抗体或对照,连续注射4周,每周注射一次,最后一次注射后五天,对小鼠进行行为测试和电生理学研究。
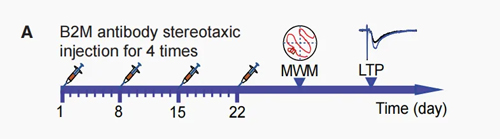
05

内容简介
本研究发现了丘脑和初级听觉皮层(A1)的环路,该环路涉及小清蛋白中间神经元( PV-IN )和丘脑输入,在抗应激方面发挥着至关重要的作用。具体来说,该回路调节个人从长期社会压力中恢复并保持心理健康的能力。此外,内侧膝状谷氨酸能神经元的早期超极化有助于应激恢复。
套管应用场景
微量给药套管埋置在 A1脑区 (AP: 2.45 mm, ML: ±4.30 mm, DV: 0.70 mm),通过连接注射泵以0.2 mL/min的速率向 A1 脑区注射 BIC、D-AP5、CNQX 或生理盐水。待药物扩散后对小鼠进行行为学实验(图M-O)。
引用文献
1.Ma, L., Day-Cooney, J., Benavides, O.J. et al. Locomotion activates PKA through dopamine and adenosine in striatal neurons. Nature 611, 762–768 (2022).
2.Ma, S., Chen, M., Jiang, Y. et al. Sustained antidepressant effect of ketamine through NMDAR trapping in the LHb. Nature 622, 802–809 (2023).
3.Wu, WL., Adame, M.D., Liou, CW. et al. Microbiota regulate social behaviour via stress response neurons in the brain. Nature 595, 409–414 (2021).
4.Gao Y, Hong Y, Huang L, Zheng S. et al. β2-microglobulin functions as an endogenous NMDAR antagonist to impair synaptic function. Cell. 2023 Mar 2;186(5):1026-1038.e20.
5.Li HY, Zhu MZ, Yuan XR, Guo ZX, Pan YD, Li YQ, Zhu XH. A thalamic-primary auditory cortex circuit mediates resilience to stress. Cell. 2023 Mar 30;186(7):1352-1368.e18.