文献速读 | AD机制研究新进展
文献速读 | AD机制研究新进展
Cell Reports:小胶质细胞P2Y6受体介导神经退行性病变中的神经元丢失和记忆减退
小胶质细胞与神经退行性病变有关,它可以通过吞噬作用清除损伤因子,对神经元起到保护作用,但是过度的吞噬则可能导致病理性的改变,目前尚不清楚机体是如何在保持小胶质细胞的有益作用的同时阻断其有害的影响。
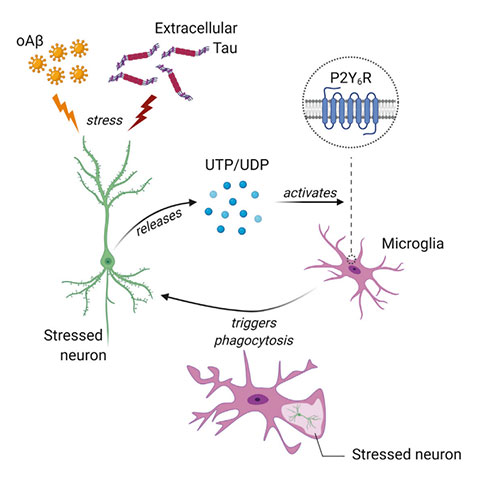
2021年12月23日,剑桥大学等机构的研究人员在《Cell Reports》杂志上发表了一篇题为“The microglial P2Y6 receptor mediates neuronal loss and memory deficits in neurodegeneration”的文章,揭示了小胶质细胞在神经退行性疾病中调节神经元凋亡以及记忆减退的细胞分子机制。小胶质细胞的吞噬作用需要依赖P2Y6受体,P2Y6受体能够被应激神经元释放的细胞外尿苷二磷酸(uridine diphosphate, UDP)激活。
研究人员通过将Aβ淀粉样蛋白注射到小鼠的大脑诱发小胶质细胞的吞噬作用,随后导致神经元的丢失和记忆的减退,这些作用效果均被P2Y6受体的敲除所阻断。在慢性神经退行性病变模型中(P301S TAU小鼠),P2Y6基因敲除能够阻止Tau蛋白诱导的神经元丢失和记忆减退。在体外实验中,P2Y6基因敲除阻断了小胶质细胞对存活而非凋亡神经元的吞噬,同时减少了神经-胶质细胞培养中Tau、Aβ以及UDP诱导的神经元丢失。
上述结果表明,P2Y6受体可能介导了Aβ和Tau诱导的小胶质细胞的吞噬功能,促进了神经退行性病变中神经元的丢失以及记忆的减退,这项工作为神经退行性疾病的治疗提供了新的靶点。
胶质和免疫细胞在神经退行性疾病中的作用已经被越来越多的人所关注。2021年12月28日,美国基因科技公司的研究人员在《Cell Reports》上发表了一篇题为“TREM2-independent oligodendrocyte, astrocyte, and T cell responses to tau and amyloid pathology in mouse models of Alzheimer disease”的文章。
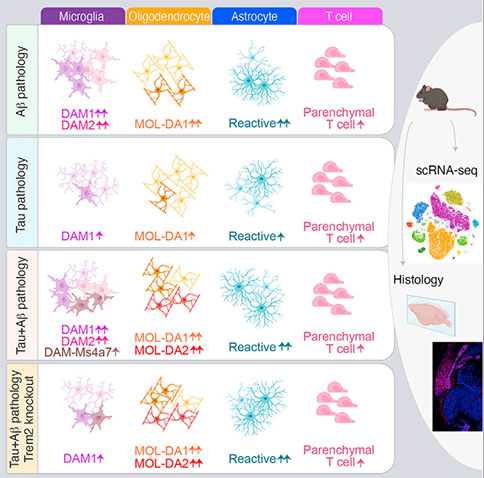
在该研究中,研究者利用单细胞转录组测序技术,对三种不同阿尔茨海默病(Alzheimer disease, AD)模型小鼠大脑海马组织中多种类型细胞进行了分析;并利用组织病理技术对它们的病理特征(包括Tau蛋白和淀粉样蛋白)进行了检测;而且研究人员还进一步比较了小胶质细胞、少突胶质细胞、星形胶质细胞和T细胞对这些病理性蛋白的反应性。该研究确定了两种不同的少突胶质细胞的转录状态以及它们的空间分布。三种动物模型中T细胞的数目均会升高。此外,该研究还观察到敲除Trem2会破坏小胶质细胞对Tau蛋白和淀粉样蛋白的反应,但其它类型的细胞对这些病理蛋白的反应相对不受影响。
该研究的结果揭示了这些细胞与AD病理反应相关的核心转录状态,以及AD关键风险基因Trem2对它们的影响。
神经炎症是阿尔茨海默氏病(Alzheimer’s disease, AD)和其它神经退行性疾病的病理标志,但其涉及的致病机制仍不明确。德国神经退行性疾病中心最近的一项研究对AD患者脑脊液炎症生物标志物水平与脑体积以及认知水平的相关性进行分析。
该研究于2022年1月10日发表在《Neuron》杂志上,文章题为“Soluble TAM receptors sAXL and sTyro3 predict structural and functional protection in Alzheimer‘s disease”。该研究发现,有痴呆先兆的受试者脑脊液中YKL-40、sTREM2、sAXL、sTyro3、MIF、补体C1q/C4/H、铁蛋白和ApoE蛋白的含量显著升高,表明神经炎症和神经退行性病变之间的紧密作用在症状出现之前就已经出现。有趣的是,脑脊液中可溶性TAM受体sTyro3和sAXL的水平与受试者MRI脑体积以及认知水平呈正相关。
该研究结果表明,在没有主观症状但潜在AD病理特征的患者中,调节神经炎症可能是一种可选的神经保护策略。
Tau蛋白聚集是阿尔茨海默病(Alzheimer’s disease, AD)的主要特征之一。虽然Tau蛋白的聚集已被证明是AD患者认知能力下降的预测因子,但是AD的进展与Tau蛋白聚集之间的相关性仍有待阐明。
2022年1月5日,凯斯西储大学等机构的研究人员在《Science Translational Medicine》杂志上发表了一篇题为“Distinct populations of highly potent TAU seed conformers in rapidly progressing Alzheimer’s disease”的文章,该研究分离并分析了不同进展AD患者Tau蛋白颗粒的结构特征,并揭示了AD进展的速度与不同Tau蛋白聚集之间的相关性。通过对40例进展不同的AD患者的Tau蛋白颗粒进行分析,研究人员确定了几种大小、结构和复制率完全不同的Tau蛋白构象。在快速进展的AD患者中,其Tau蛋白颗粒主要由快速复制、明显错误折叠的Tau蛋白聚集而成,包含了~80%的四重错误折叠 (4R)Tau蛋白和~20%的三重错误折叠(3R)Tau蛋白,并且这两种Tau蛋白亚型具有相同的构象特征。
上述结果表明,明显错误折叠的4R Tau蛋白构象群能够驱动AD的快速进展,这意味着有效的AD治疗策略可能需要考虑不同错误折叠的Tau蛋白构象特征。
小胶质细胞与神经退行性病变有关,它可以通过吞噬作用清除损伤因子,对神经元起到保护作用,但是过度的吞噬则可能导致病理性的改变,目前尚不清楚机体是如何在保持小胶质细胞的有益作用的同时阻断其有害的影响。
2021年12月23日,剑桥大学等机构的研究人员在《Cell Reports》杂志上发表了一篇题为“The microglial P2Y6 receptor mediates neuronal loss and memory deficits in neurodegeneration”的文章,揭示了小胶质细胞在神经退行性疾病中调节神经元凋亡以及记忆减退的细胞分子机制。小胶质细胞的吞噬作用需要依赖P2Y6受体,P2Y6受体能够被应激神经元释放的细胞外尿苷二磷酸(uridine diphosphate, UDP)激活。
研究人员通过将Aβ淀粉样蛋白注射到小鼠的大脑诱发小胶质细胞的吞噬作用,随后导致神经元的丢失和记忆的减退,这些作用效果均被P2Y6受体的敲除所阻断。在慢性神经退行性病变模型中(P301S TAU小鼠),P2Y6基因敲除能够阻止Tau蛋白诱导的神经元丢失和记忆减退。在体外实验中,P2Y6基因敲除阻断了小胶质细胞对存活而非凋亡神经元的吞噬,同时减少了神经-胶质细胞培养中Tau、Aβ以及UDP诱导的神经元丢失。
上述结果表明,P2Y6受体可能介导了Aβ和Tau诱导的小胶质细胞的吞噬功能,促进了神经退行性病变中神经元的丢失以及记忆的减退,这项工作为神经退行性疾病的治疗提供了新的靶点。
胶质和免疫细胞在神经退行性疾病中的作用已经被越来越多的人所关注。2021年12月28日,美国基因科技公司的研究人员在《Cell Reports》上发表了一篇题为“TREM2-independent oligodendrocyte, astrocyte, and T cell responses to tau and amyloid pathology in mouse models of Alzheimer disease”的文章。
在该研究中,研究者利用单细胞转录组测序技术,对三种不同阿尔茨海默病(Alzheimer disease, AD)模型小鼠大脑海马组织中多种类型细胞进行了分析;并利用组织病理技术对它们的病理特征(包括Tau蛋白和淀粉样蛋白)进行了检测;而且研究人员还进一步比较了小胶质细胞、少突胶质细胞、星形胶质细胞和T细胞对这些病理性蛋白的反应性。该研究确定了两种不同的少突胶质细胞的转录状态以及它们的空间分布。三种动物模型中T细胞的数目均会升高。此外,该研究还观察到敲除Trem2会破坏小胶质细胞对Tau蛋白和淀粉样蛋白的反应,但其它类型的细胞对这些病理蛋白的反应相对不受影响。
该研究的结果揭示了这些细胞与AD病理反应相关的核心转录状态,以及AD关键风险基因Trem2对它们的影响。
神经炎症是阿尔茨海默氏病(Alzheimer’s disease, AD)和其它神经退行性疾病的病理标志,但其涉及的致病机制仍不明确。德国神经退行性疾病中心最近的一项研究对AD患者脑脊液炎症生物标志物水平与脑体积以及认知水平的相关性进行分析。
该研究于2022年1月10日发表在《Neuron》杂志上,文章题为“Soluble TAM receptors sAXL and sTyro3 predict structural and functional protection in Alzheimer‘s disease”。该研究发现,有痴呆先兆的受试者脑脊液中YKL-40、sTREM2、sAXL、sTyro3、MIF、补体C1q/C4/H、铁蛋白和ApoE蛋白的含量显著升高,表明神经炎症和神经退行性病变之间的紧密作用在症状出现之前就已经出现。有趣的是,脑脊液中可溶性TAM受体sTyro3和sAXL的水平与受试者MRI脑体积以及认知水平呈正相关。
该研究结果表明,在没有主观症状但潜在AD病理特征的患者中,调节神经炎症可能是一种可选的神经保护策略。

Tau蛋白聚集是阿尔茨海默病(Alzheimer’s disease, AD)的主要特征之一。虽然Tau蛋白的聚集已被证明是AD患者认知能力下降的预测因子,但是AD的进展与Tau蛋白聚集之间的相关性仍有待阐明。
2022年1月5日,凯斯西储大学等机构的研究人员在《Science Translational Medicine》杂志上发表了一篇题为“Distinct populations of highly potent TAU seed conformers in rapidly progressing Alzheimer’s disease”的文章,该研究分离并分析了不同进展AD患者Tau蛋白颗粒的结构特征,并揭示了AD进展的速度与不同Tau蛋白聚集之间的相关性。通过对40例进展不同的AD患者的Tau蛋白颗粒进行分析,研究人员确定了几种大小、结构和复制率完全不同的Tau蛋白构象。在快速进展的AD患者中,其Tau蛋白颗粒主要由快速复制、明显错误折叠的Tau蛋白聚集而成,包含了~80%的四重错误折叠 (4R)Tau蛋白和~20%的三重错误折叠(3R)Tau蛋白,并且这两种Tau蛋白亚型具有相同的构象特征。
上述结果表明,明显错误折叠的4R Tau蛋白构象群能够驱动AD的快速进展,这意味着有效的AD治疗策略可能需要考虑不同错误折叠的Tau蛋白构象特征。

相关推荐
评论列表共有 0 条评论
暂无评论
发表评论
取消回复