脑内毛细血管小胶质细胞通过PANX1-P2RY12信号调节血管的结构和功能
大脑的能量供应依赖其丰富而密集的血管系统。大脑的血管系统与其它器官不一样,它由神经血管单元(Neurovascular Unit,NVU)组成,而NVU由多种血管细胞(如内皮细胞、周细胞、平滑肌细胞、血管周围巨噬细胞)和大脑细胞(如星型胶质细胞、神经元)组成。小胶质细胞是大脑的免疫细胞,它在大脑发育、内环境成熟稳定以及疾病发生过程中发挥了重要作用,但是它与大脑血管系统的相互作用及其潜在的血管生理调节功能尚未得到阐明。
2021年9月6日,弗吉尼亚大学医学院等研究团队在《Nature Communications》发表题为“Capillary-associated microglia regulate vascular structure and function through PANX1-P2RY12 coupling in mice”的文章,该研究通过分子、形态学和超微结构解析等方法证实了分支状CX3CR1+髓样细胞是一类小胶质细胞,是NVU的组成成分,并且该研究还阐明了这些小胶质细胞在脑毛细血管生理调节中的作用。
1、分子、形态学和电子显微镜分析的结果表明,与脑毛细血管相关的分支状CX3CR1+髓样细胞是一类小胶质细胞;
2、毛细血管相关小胶质细胞(Capillary-associated Microglia,CAMs)表现出在血管系统上富集的特征;CAMs与毛细血管的相互作用通过更加稳定的胞体接触来实现;
3、CAMs与毛细血管的相互作用至少部分受到由Pannexin 1(PANX1)通道释放的嘌呤所激活的嘌呤能P2RY12信号的调控;
4、通过药物消除CAMs导致毛细血管扩张、血流增加和血管扩张受损,与P2RY12和PANX1缺失小鼠表现相同。
二、研究结果分析
1.分支状CX3CR1+髓样细胞与脑内毛细血管具有密切联系。
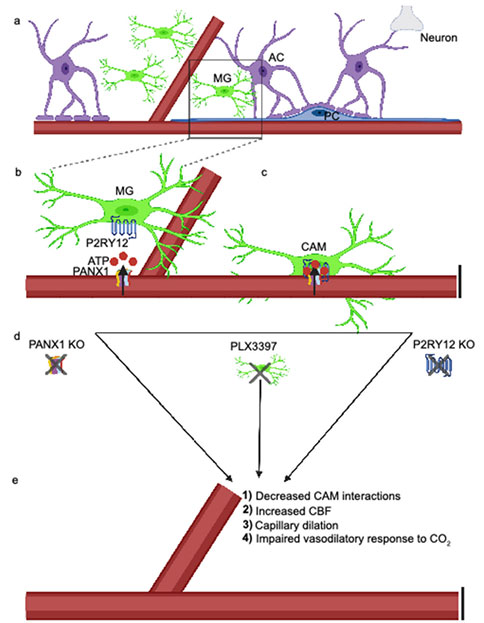
研究者通过对CX3CR1GFP/+小鼠大脑进行在体双光子成像,观察到CX3CR1+髓样细胞胞体附着在不同大小和深度的血管上。研究者重点关注直径约5-10微米的毛细血管,此类毛细血管床是脉管系统中最复杂的组成部分,也是氧气/营养物质输送和废物吸收的场所,经常经历复杂的重塑过程。成像分析显示分支状GFP+细胞胞体紧密附着于毛细血管,而它们的分支延伸到大脑内部。进一步通过与星形胶质细胞(已知的NVU组成部分)进行比较,研究者观察到在皮层毛细血管上,毛细血管相关的CX3CR1+髓样细胞的密度明显高于毛细血管相关的星形细胞体的密度,但是远低于毛细血管周细胞的密度。这些结果表明此类分枝状的CX3CR1+髓样细胞与大脑毛细血管有关。
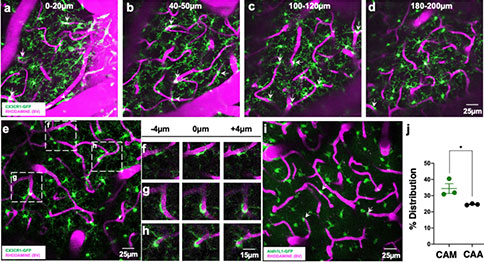
脑内髓样细胞包括分支状小胶质细胞、血管旁巨噬细胞、脑膜巨噬细胞和脉络丛巨噬细胞四种。这些皮质毛细血管相关的GFP+细胞首先可以排除是脑膜或脉络膜丛巨噬细胞。并且血管旁巨噬细胞位于两根血管基底膜之间,小胶质细胞位于脑实质血管壁基底膜外。通过电镜观察到这些毛细血管相关的髓样细胞处于大脑不同区域的脑实质血管基底膜外。此外,这些髓样细胞的细胞体直接靠近相应的血管并与血管基底膜接触,而不干涉星形细胞突起。利用血管旁巨噬细胞标记物CD206对CX3CR1GFP/+组织进行染色,大多数GFP+细胞表现为CD206阴性,并且CD206+细胞主要位于大血管和脑膜附近。利用小胶质细胞特异性标记物P2YR12对CX3CR1GFP/+组织进行染色,几乎所有非脑膜GFP+细胞都是P2RY12+(97.16 ±0.52%)。
这些结果表明分枝状的CX3CR1+髓系细胞是一类小胶质细胞。研究者将这类与毛细血管有关联的分支状CX3CR1+髓样细胞称为CAMs。大脑皮层、丘脑和海马中CAMs的密度相似, 3D扫描重建结果显示CX3CR1+细胞胞体和毛细血管之间直接接触。血管系统占据大脑体积总量的~6.1%,但是CAMs占了大脑中GFP+细胞的30%。这表明CAMs在血管系统中富集。
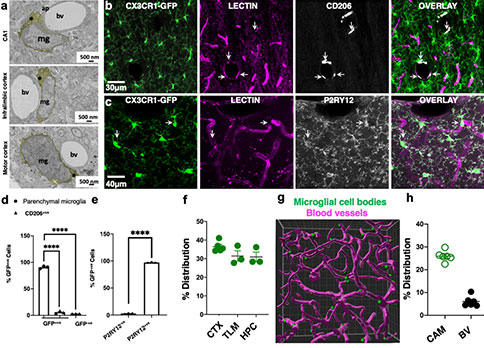
CAMs根据在毛细管壁上的位置,至少可以划分出三种类型,包括胞体与毛细血管平行排列的线性CAMs、用双极突起包裹毛细血管的CAMs、以及其躯体位于毛细血管分叉处的连接CAMs。CAMs与PCMs的区别在于它们的位置。因此,为了进一步表征CAMs,研究者比较了二者Sall1(髓样细胞中唯一的小胶质细胞转录因子)的表达,没有发现显著差异。对它们静态和动态形态特征进行比较,CAMs初生突起数目有轻微但是显著的减少,胞体面积增大,但细胞区域相同。在对激光损伤的反应中,CAMs与PCMs都表现出突起定向延伸。通过对CAMs动态成像,观察到稳定的CAMs最为丰富。这些结果表明,CAMs是一类胞体延伸到毛细血管的替代PCMs的小胶质细胞。

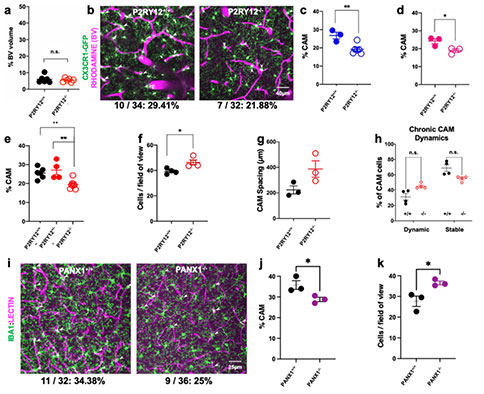
嘌呤能P2RY12受体可以控制大脑皮层中有一小群小胶质细胞(~ 5-8%)的迁移。因此,研究者探讨了P2RY12在CAMs中的作用。P2RY12−/−小鼠并没有表现出明显的血管密度缺陷,但是P2RY12−/−小鼠的CAMs密度有显著降低。在P2RY12−/−小鼠中,CAMs密度的降低并不是小胶质细胞数量减少的结果,因为这些小鼠的小胶质细胞的密度反而有少量升高。P2RY12−/−小鼠的CAMs沿血管的平均间距也比野生型小鼠更大,提示P2RY12−/−小鼠的CAMs对血管监测可能较差。
对CAMs进行动态监测,P2RY12−/−小鼠没有表现出稳定型或动态型CAMs的改变,表明这种动态作用不受P2RY12的调控。由于P2RY12 能够被PANX1所释放的嘌呤激活,研究者检测了PANX1−/−小鼠的小胶质细胞和CAMs的密度,PANX1−/−小鼠的小胶质细胞密度显著升高,CAMs密度显著降低。这些结果表明小胶质细胞的密度和CAMs的相互作用依赖P2RY12和PANX1进行调节。
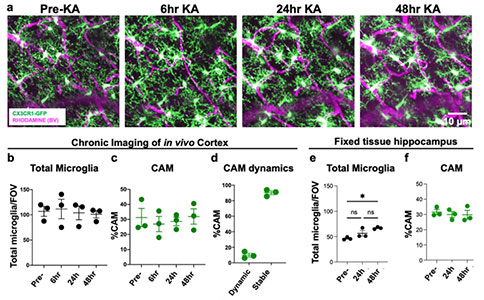
随后,研究者探讨了CAMs是否受神经元活动的影响。为此,研究者对小鼠植入长期颅窗,并在红藻酸(Kainic Acid,KA)诱发癫痫过程中对小鼠大脑中CAMs进行观察。在KA诱发癫痫发作前以及随后的48小时中,尽管小胶质细胞的形态发生了一些变化,但小胶质细胞的密度和CAMs群体的百分比仍然保持不变,并且CAMs动态变化也不受癫痫发作的影响。此外,海马中小胶质细胞密度和CAM密度同样不受癫痫的影响,表明CAMs的相互作用和动力学并未因神经元活动增加而改变。
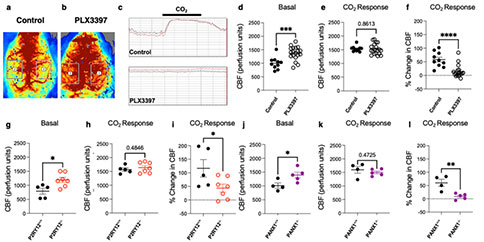
为了确定CAMs是否是小胶质细胞的固有子集,研究者使用一种CSF1R抑制剂PLX3397来消除或重新补充小胶质细胞。PLX3397处理有效地消除了小胶质细胞,停止给药,小胶质细胞迅速重新聚集。在PLX3397处理期间,小胶质细胞和CAMs总量下降,停药后恢复。但是,CAMs密度在消除后重新恢复的整个过程中保持不变,表明小胶质细胞中CAMs密度是固有调节的。PLX3397处理期间保留了整个血管结构,即没有新的血管形成,也没有现有的血管丢失。然而,PLX3397处理4天后毛细血管直径增加了~15%,这表明小胶质细胞有助于维持毛细血管直径。
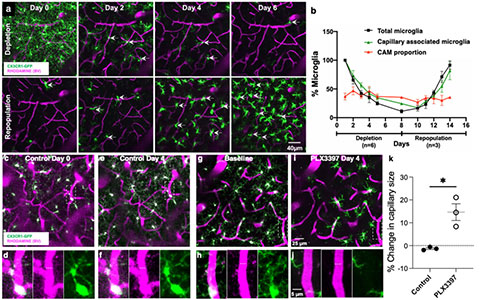
由于观察到毛细血管的扩张,研究者利用激光散斑成像来监测脑血流量,发现PLX3397处理后脑血流量增加了约20%。此外,PLX3397处理后,毛细血管对CO2(可使血管扩张)的反应显示出损伤的趋势。提示小胶质细胞能够调节血流动力学,至少在血管反应性的一些方面是必要的。P2RY12-和PANX1-缺陷小鼠均显示CAMs相互作用减少,研究者假设这一分子机制也可以调节脑血流量和血管舒张。
为了验证这一假设,研究者利用野生型、P2RY12−/−和PANX1−/−小鼠重复上述实验。与PLX3397处理的结果一致,研究者观察到P2RY12和PANX1缺失导致基础灌注水平增加以及毛细血管对CO2的血管扩张受损。这些结果表明,PANX1释放的嘌呤促进小胶质细胞与毛细血管相互作用,在稳定状态下调节血管灌注和反应性。
综上所述,该研究结果证实了CAMs在毛细血管上的富集,阐明了CAMs相互作用由PANX1-P2RY12信号进行调控,为CAMs参与毛细血管结构的维持、脑血流量的调节和血管舒张提供了证据。这些结果有力的证实了CAMs是NVU的重要组成部分,并建议进一步探讨小胶质细胞对血管结构和功能的贡献。
这项研究用到了在体双光子成像技术、组织免疫荧光、透射电镜、以及激光散斑血流成像系统来观察颅内CAMs的形态以及毛细血管血流的变化。瑞沃德深耕神经科学研究领域近20年,一直致力于为客户提供可信赖的解决方案和服务,可提供这项工作中涉及的动物手术、在体双光子成像、组织免疫荧光、以及激光散斑血流成像的完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球700+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章12000+,获得行业广泛认可。