Western Blot实验的难点和痛点
本期的投稿来自北京大学的艾同学,与前一篇不同的是,这次不仅帮大家把实验步骤整理成了表格形式,更是详细解析了Western Blot实验的难点和痛点,势必要帮助大家攻克西方印迹!
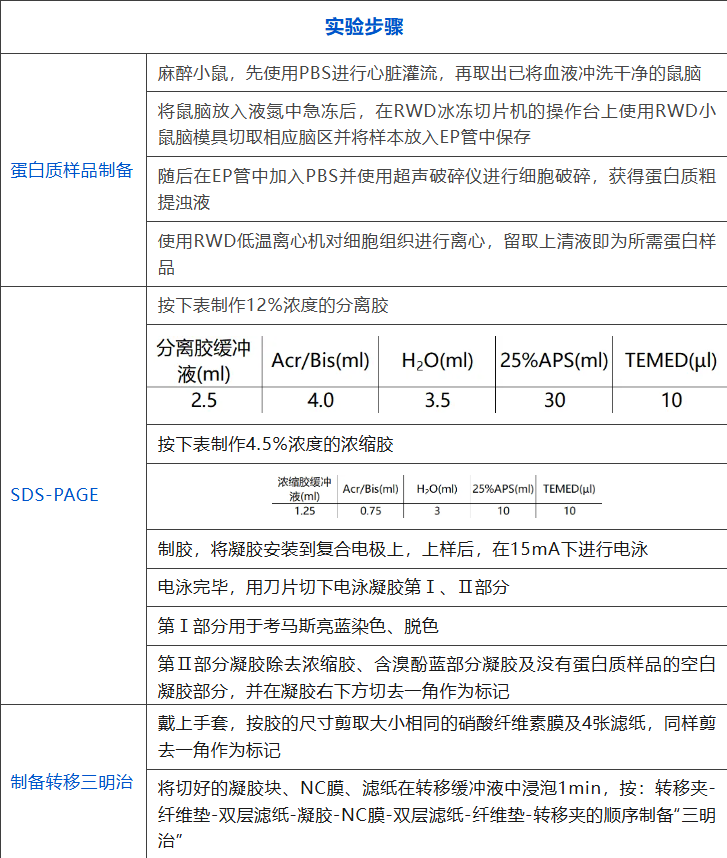
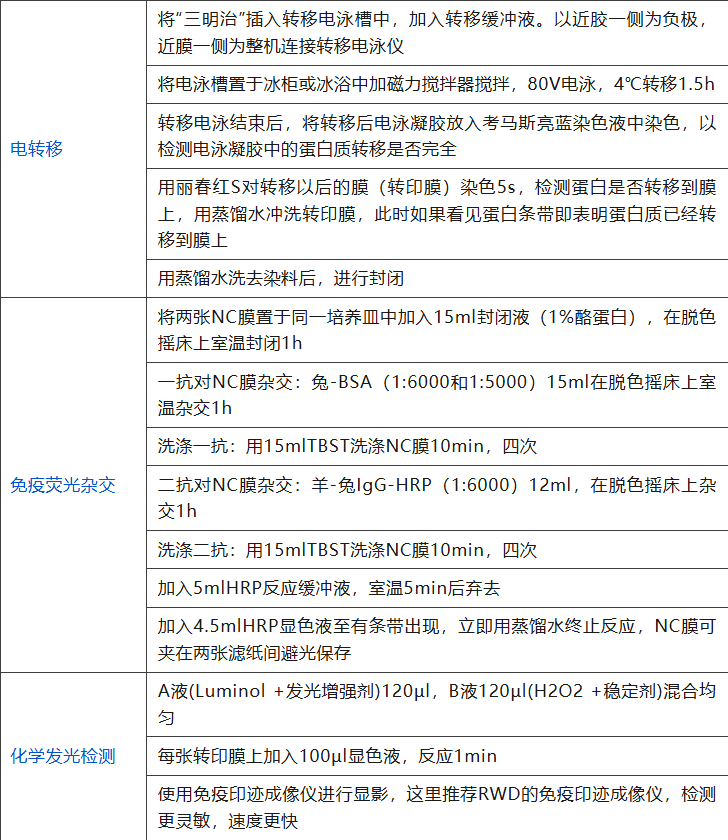
WB操作步骤
WB实验痛点及其解决方法
对于蛋白类实验来讲,最大的痛点应该就是制备得到的蛋白样品浓度不够、出现降解,或者不同个体提取的样品含量不均一的问题。解决此问题的方法首先定是苦练技术,保证自己对每一步取样流程都形成肌肉记忆。其次可以借助工具对所取样品进行定量,例如使用RWD的脑模具能保证徒手切片的厚度为1 mm,或者使用震动切片机进行切片取样,也能保证样品的厚度,同时如果获取的是一定区域的组织样品可定制相应形状的模具以规范实验操作。最后为了保持蛋白的稳定性,可以在取样时加入抑制剂,并保持样品的低温保存状态。
第二大的痛点就是所获得的条带与标准结果相差甚远,主要的问题条带类型有条带中出现杂质、条带出现拖尾或者弯曲等。解决杂质问题应了解杂质的产生来源于试剂中能与Luminol结合的结晶或杂蛋白,所以首先应使用现配的工作液,并且在洗膜时应充分保证膜的平整以及摇床转速的适中。拖尾是蛋白量过大堆积不易通过凝胶进行移动导致的故应重新调整分离胶的浓度,选择更合适的凝胶进行电泳。条带弯曲是蛋白在凝胶中泳动时受力不均导致的,故可能的本质原因有电压不均、凝胶有气泡不均一、或两头孔位有别的阻力等,根据不同的原因进行相应的改正即可。
最后一大痛点就是转膜的效果不好。转膜效果不好多是甲醇浓度不适或操作有气泡导致,所以应该调整甲醇的浓度使得蛋白与凝胶之间的作用力降低但又不至于完全脱离NC膜,并在操作当中小心谨慎的排除气泡,不可心急求快。
WB实验难点及其解决方法
WB的技术难点主要聚焦在选择合适的凝胶浓度、合适的电泳时间与电压、合适的转膜时间与合适的抗体稀释浓上。
凝胶的浓度取决于想要分离得到的蛋白浓度,要使不同分子量的蛋白充分延展,又要使蛋白不至于太容易泳出泳道。6%分离胶适用于中等至较大分子量的蛋白质(50-150 kD);8%分离胶适用于较小分子量的蛋白质(30-90 kD);10%分离胶适用于更小分子量的蛋白质(20-80 kD);12%分离胶适用于非常小的分子量蛋白质(12-60 kD);更小分子量的蛋白(10-40 kD)则采用15%的分离胶。
电泳的时间及电压一般通过在预实验里观察前端的溴酚蓝条带判断,溴酚蓝条带既不可泳动太慢导致实验耗时过长,又不可泳动过快导致条带出现分离不充分、拖尾等情况。一般建议溴酚蓝在分离胶中存在的时间为一小时以上为宜。
转膜时间主要由蛋白的分子量决定。分子量越小转膜时间应更短,避免转膜过度丢失蛋白,或可使用两张膜进行同时转移就算转移过度小分子量蛋白仍存在于后一张膜上而未丢失;分子量越大则转膜时间应更长,避免蛋白未能成功转移,但具体参数仍需通过预实验获得。
抗体的稀释浓度一般采用购置抗体的推荐浓度使用。如果是一抗可先使用高浓度进行孵育,就算孵育结果不理想后续实验可逐步稀释抗体浓度来测试合适的稀释度,但二抗仅能一次性使用,建议获取经验数值进行使用。文末福利