抑制星胶释放的ATX可降低卒中后兴奋性毒性并改善预后
文章概述
中风是全球死亡的第二大原因,也是致残的主要原因。缺血性中风是由于血液供应不足进而引起神经元功能中断和细胞死亡,并最终导致脑组织持续丢失以及身体残疾。中风治疗的目的是挽救缺血半暗带中功能受损但仍有活力的组织,但是过量的谷氨酸传递会导致涉及谷氨酸受体的兴奋性神经元死亡以及随后的钙超载。到目前为止,通过直接抑制谷氨酸传递来拯救缺血半暗带的治疗都以失败告终,因此,靶向性的针对神经元兴奋性毒性进行治疗,对于缺血性脑卒中的治疗十分必要。
2022年4月20日,德国美因兹大学医学中心的研究人员在《Science Translational Medicine》期刊上发表题为“Inhibition of the enzyme autotaxin reduces cortical excitability and ameliorates the outcome in stroke”的研究论文。研究证实,星形胶质细胞释放的自分泌运动因子(Autotaxin, ATX)作为合成溶血磷脂酸(Lysophosphatidic Acid, LPA)的酶,可通过LPA2受体相关的突触脂质信号来调控谷氨酸的传递,并参与脑损伤后神经兴奋性毒性的过程,而抑制ATX的活性能够改善缺血性脑卒中的预后。该研究结果表明,ATX可能在脂质信号转导中起重要作用,有望成降低脂质相关的皮质过度兴奋的潜在治疗靶点,为脑卒中等相关疾病的治疗提供新的思路。

核心观点
1、星形胶质细胞释放的ATX与脑卒中的梗死体积以及卒中预后有关,在缺血性脑卒中动物模型或中风患者的脑脊液中,ATX浓度明显增加;
2、条件性敲除ATX或者利用药理手段抑制ATX,可以抑制LPA相关的皮层兴奋性并改善脑卒中的预后;
3、突触LPA信号介导的皮质兴奋性决定了MCAO的预后,突触LPA信号失调导致随后的脑卒中预后不良;
4、在动物模型中抑制ATX可改善脑卒中的预后,表明该方法可能对脑卒中治疗具有转化应用潜力。
研究结果分析
1. 星形胶质细胞释放的ATX与梗死体积和卒中预后有关
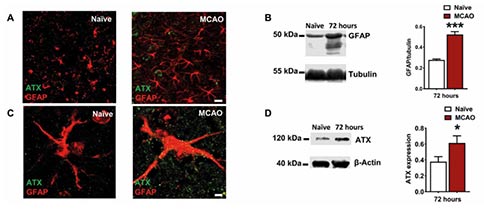
发生缺血性卒中后,反应性星形胶质细胞在梗死区域周围积聚并形成胶质瘢痕。在小鼠大脑中动脉(Middle Cerebral Artery, MCAO)闭塞引起的缺血性卒中模型中,研究者发现梗死区域周围GFAP阳性的星形胶质细胞数量增加,受损半球皮层GFAP的表达增加。由于突触脂质信号能够调节中风后损伤扩散相关的谷氨酸传递,因此研究者分析LPA合成酶ATX的数量。与非转基因小鼠相比,MCAO小鼠大脑梗死区域激活的星形胶质细胞上以及周围存在大量的ATX阳性点状突起,这与星形胶质细胞中ATX的表达增加以及释放的模式相一致。此外,Western Blot分析证实,MCAO损伤半球中的ATX水平显著增加。
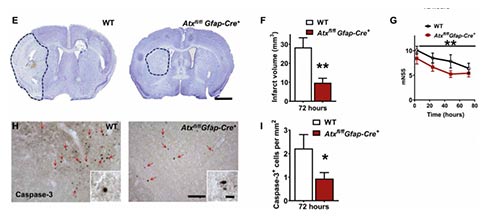
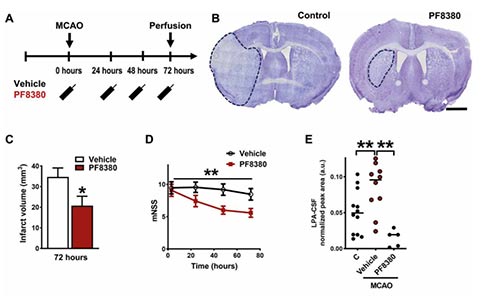
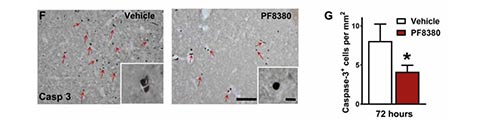
为了评估星形胶质细胞ATX在MCAO中的作用,研究者构建了星形胶质细胞中ATX特异性缺失的小鼠。利用这种小鼠进行MCAO造模,研究者观察到,造模后的72h小鼠脑梗死体积显著减少,动物运动功能评分明显改善,提示星形胶质细胞中的ATX在脑卒中预后功能中发挥了关键作用。为了进一步评估细胞凋亡情况,研究者对组织中活化的Caspase-3进行了量化,其在ATX特异性缺失的小鼠中显著减少,这进一步支持了星形胶质细胞分泌的ATX在脑卒中病理中的重要作用。
2. 脑卒中后患者脑脊液中ATX和LPA显著升高
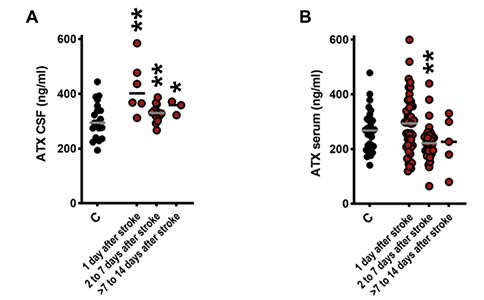
研究者评估了人脑皮层星形胶质细胞突起和谷氨酸突触附近ATX的分布,并测量了脑卒中后患者脑脊液和血清中ATX的浓度。结果显示,皮层中ATX的定位与谷氨酸能突触的位置接近;并且在急性中风后,一直持续到第14 d,患者脑脊液中ATX浓度显著升高。这种增加仅限于中枢神经系统,与对照组相比,卒中后患者血清中ATX的浓度明显降低。
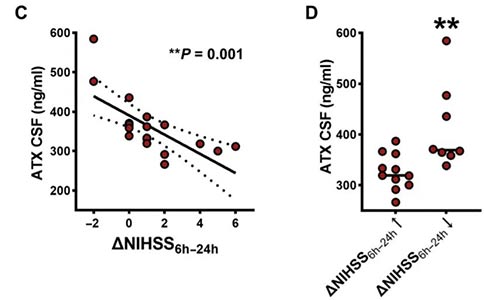
为了进一步分析ATX在卒中预后中的作用,研究者将ATX的浓度与入院后24 h内患者的卒中量表评分的改善情况进行了相关性分析,结果显示,评分的改善与脑脊液中高ATX浓度呈负相关。与入院后24 h内评分出现改善的患者相比,评分没有改善的患者脑脊液中ATX浓度明显更高。这些数据表明,在脑卒中患者中,脑脊液中高浓度的ATX对患者的预后不利。
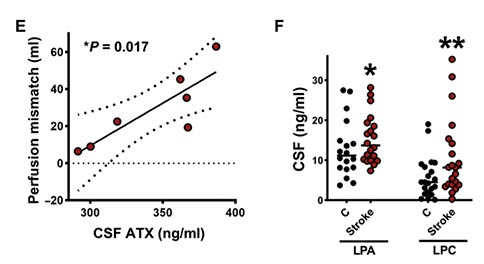
此外,研究者还观察到灌注不匹配区域的体积与脑脊液中ATX的浓度呈正相关,表明ATX的增加在半暗带的扩张中发挥了作用。ATX是LPA的主要胞外合成分子,LPA是一种有效但寿命短的生物活性磷脂,可显著增加突触前囊泡释放的可能性。因此,研究者通过质谱定量了脑脊液中LPA及其前体LPC的浓度,与对照组相比,卒中后患者脑脊液中的LPA及其前体LPC的浓度显著增加。这些数据表明,谷氨酸刺激了更高的ATX产生,并导致更高的LPA数量,使得兴奋/抑制(E/I)平衡的改变,这与急性卒中患者突触脂质诱导的皮质兴奋性有关。
3. 抑制ATX可促进MCAO后半暗带的修复并改善神经功能
上述结果表明,脑卒中诱导的星形胶质细胞中ATX的上调可促进细胞死亡,ATX是LPA的主要来源。因此,研究者随后探讨了ATX缺失所产生的作用是否是由减少LPA的产生所介导。研究者评估了MCAO后药物抑制ATX作为卒中后半暗带拯救策略的作用。为此,研究者使用了一种高效且特异的小分子ATX抑制剂PF8380,它专门针对ATX的LPA合成功能。PF8380治疗显著降低MCAO后72 h的梗死体积,并显著改善行为评分。脑脊液中LPA的检测显示,MCAO后24 h内 LPA显著增加,ATX抑制后LPA显著降低。与对照相比,ATX抑制显著降低了Caspase-3活化相关的细胞凋亡。这些数据证实,LPA合成酶ATX通过LPA信号在局灶性脑缺血的病理中发挥了重要作用,系统性的靶向ATX可能是改善小鼠缺血性卒中预后功能的有效策略。
4. 突触LPA信号介导的皮质兴奋性决定了MCAO的预后
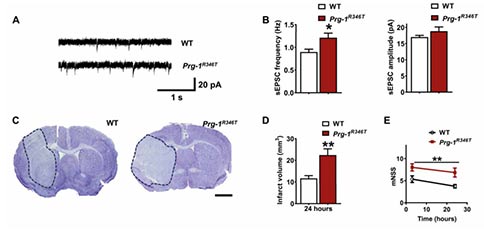
为了进一步研究LPA信号在脑卒中病理中的作用,研究者构建了Prg-1功能丧失的Prg-1R346T小鼠。已有研究表明,PRG-1通过调节LPA的摄入从而调节谷氨酸的突触传递,Prg-1突变导致突触LPA浓度升高,皮质兴奋性增加,并改变了E/I平衡。结果显示,Prg-1R346T小鼠表现出更高的自发谷氨酸活动,这是LPA介导的皮质兴奋性增加的潜在原因。与对照相比,Prg-1R346T小鼠24 h后梗死体积、不良行为以及Caspase-3相关的细胞凋亡明显增加。此外,Prg-1R346TMCAO小鼠中与神经轴突损伤以及脑卒中死亡相关的标志物NfL同样显著增加,提示MCAO后这些小鼠的神经元损伤更严重。总之,这些数据表明,轻度的LPA相关的皮质过度兴奋对中风病理有不利的影响。
最后,研究者利用Prg-1-/-/Lpa2-/-小鼠,验证了突触LPA信号是否会导致皮质过度兴奋,从而造成更糟糕的卒中预后。结果显示,突触前LPA2受体的缺失可以完全拯救由PRG-1缺失引起的高LPA所致的皮质过度兴奋。Prg-1R346T小鼠表现出更高的皮质兴奋性和梗死体积,而Prg-1-/-/Lpa2-/-小鼠,由于缺乏突触前的LPA2受体,因此表现出突触LPA信号中断,与同窝野生型小鼠相比,具有相似的皮质兴奋性、梗死体积以及神经功能评分。这些数据强烈支持突触LPA信号通过调节皮质的兴奋性参与中风的病理过程。

5. 抑制ATX 改变了E/I平衡并拯救了卒中的预后
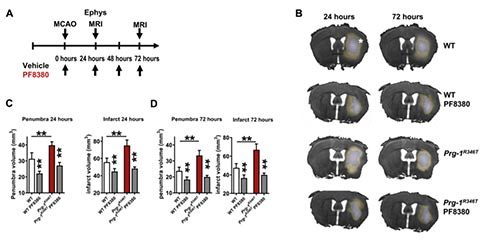
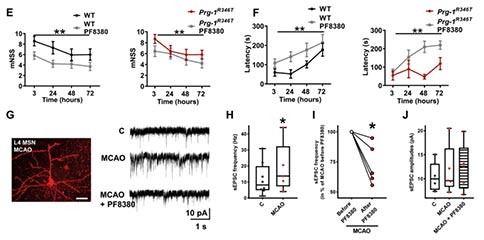
为了研究阻断ATX诱导的神经兴奋性毒性在中风后的转化应用潜能,作者分析了抑制ATX是否能够拯救Prg-1R346T小鼠中明显较高的MCAO后遗症。MCAO后,Prg-1R346T小鼠连续3天使用ATX抑制剂PF8380,并在MCAO后24和72 h接受磁共振成像(MRI)来评估半暗带和梗死核心。Prg-1R346T小鼠经PF8380处理后其MCAO的半暗带和梗死核心得到改善,梗死体积的减少和皮质兴奋性的降低同样也转化为神经和运动功能的改善,并且经其活化的Caspase-3阳性凋亡细胞数量也显著减少。这些数据表明,抑制ATX的作用降低了过量的LPA,并使大脑中预先存在的皮层兴奋性正常化,即使存在缺血性中风样的有害病理因素。
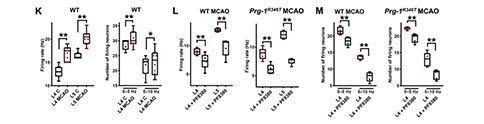
为了进一步证实突触脂质信号在脑卒中谷氨酸传递中的作用,研究者在单个神经元水平和在体皮层网络水平进行了电生理评估。结果显示,与对照组相比,MCAO后24 h,缺血半暗带皮层神经元的自发兴奋性突触后电流(sEPSCs)活动显著增强,而当ATX被PF8380抑制时,这些神经元的sEPSC减少。与之一致的是,在体的电生理记录结果显示,MCAO后皮层第4和第5层的活跃神经元数量显著增加,皮层神经元放电频率显著增加;在ATX被抑制后,MCAO小鼠的放电频率和活跃神经元数量均显著减少。总之,这些数据支持ATX在LPA诱导的皮层过度兴奋性所驱动的缺血半暗带持续神经元丢失过程中的重要性。
6. 突触脂质信号转导是影响小鼠和人卒中预后的重要因素
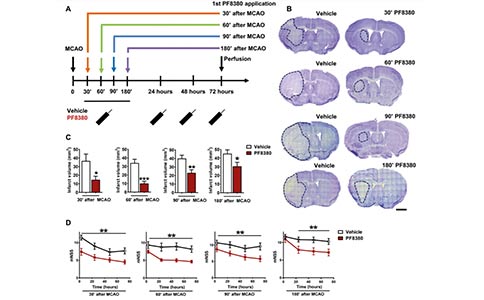
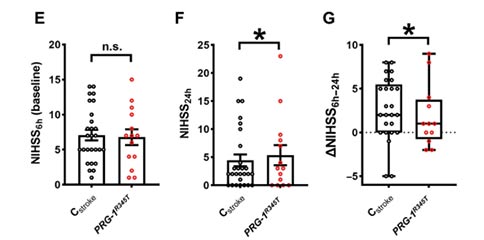
为了评估ATX抑制对卒中预后的潜在治疗作用,作者评估了在MCAO后不同时间点(30、60、90和180 min)应用PF8380的效果。结果表明,在这些不同的时间点给予PF8380,均能使MCAO后72 h的脑梗死体积显著减少,并且对卒中预后也有显著改善。与对照相比,PF8380处理的动物在MCAO后3 h就显示出更好的神经系统状态,并在72 h内持续改善。为了评估突触脂质信号在卒中患者中的作用,作者分析了那些携带Prg-1单等位基因突变(与上述Prg-1R345T同源)患者的卒中量表评分。携带Prg-1R345T的患者在入院6小时内的卒中评分与对照组没有差别,但是在入院后24 h的卒中评分显著高于对照组,其相对于入院6小时评分的改善情况显著低于对照组。这些数据表明,突触脂质信号是影响患者长期脑卒中预后的重要病理因素,因此抑制ATX是临床治疗脑卒中的一个潜在治疗选择。
总结
亮点研究方法