mPFC-Notch1信号通过Hes1抑制GABAB1受体表达介导METH诱导的精神障碍
甲基苯丙胺(METH,冰毒)是一种被广泛滥用的兴奋剂药物,其具有强烈的成瘾性,并且大剂量或长期使用METH会诱发精神障碍(MIP)。MIP表现出与精神分裂症(SCZ)相似的症状,包括多动、躁动及认知缺陷等,尽管SCZ和MIP有相似之处,但MIP的发病机制与SCZ不同,目前人们对其发病机制还知之甚少。虽然Notch1信号通路已被证明在一些精神疾病的发病机制中发挥作用,但其在MIP中的作用仍不清楚。
2022年6月22日,西安交通大学法医学院陈腾教授、官方霖教授团队等在Molecular Psychiatry期刊上发表“Medialprefrontal cortex Notch1 signalling mediates methamphetamine-inducedpsychosis via Hes1-dependent suppression of GABAB1 receptor expression”的研究工作。这项研究揭示了mPFC神经元Notch1信号通路在调控MIP中的重要作用,并提出了Notch1-Hes1-GABAB1途径调控MIP的新机制。

高度保守的Notch信号通路参与干细胞的发育及分化。Notch受体Notch1可以调节从无脊椎动物到哺乳动物大脑功能中的突触可塑性和长期记忆。而在MIP中突触可塑性和记忆能力均受到影响,这意味着Notch1可能与MIP的神经功能损伤有关。已有研究表明,Notch1失衡与多种精神疾病的发病机制相关,如SCZ、抑郁和焦虑。然而,Notch1通路是否以及如何参与MIP仍不清楚。在冰毒致敏后,小鼠mPFC、伏隔核(NAc)和海马(Hip)中GABA转运体和受体的表达发生变化,而Notch1信号转导与GABA转运体或受体存在关联。因此,作者推测Notch1信号通过调控GABA能基因表达参与MIP神经功能障碍。
01 首先,研究人员建立了METH小鼠模型(METH sensitized),并对其进行了旷场实验验证其表型。结果显示METH小鼠具有显著的焦虑样表型。然后作者评估了与精神病相关的mPFC、NAc和海马脑区的Notch1信号水平,其中仅有mPFC中Notch1、Jagged1、RBP-J和Hes1信号相关的mRNA水平下降,而NAc、海马中则没有变化。因此,作者选择mPFC作为目标脑区。随后作者建立SCZ小鼠模型,并对其进行了行为学测试。结果显示:SCZ小鼠在旷场中活动能力增强而在中央停留时间减少,高架迷宫(EPM)中进入开放臂的次数减少,社交测试(SIT)中社交时间减少,悬尾测试(TST)中静止时间增加,新物体识别测试(NOR)中认知得分减少。这些表型确实与METH致敏小鼠类似,然而在SCZ小鼠mPFC中,Notch1信号相关的mRNA水平未发生显著变化。
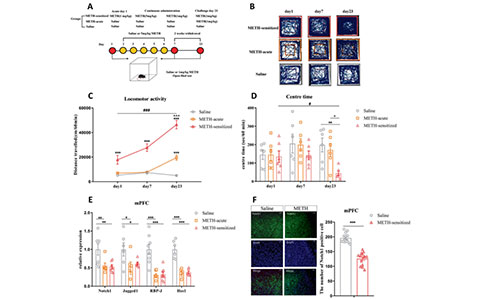
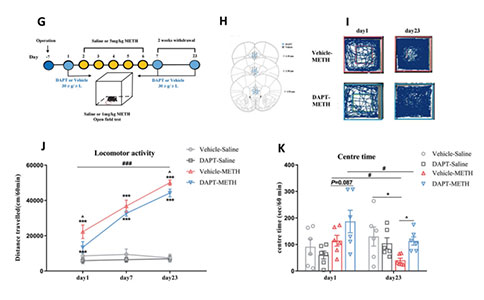
图2:Notch1信号通路在METH致敏小鼠mPFC中特异性下调
02 在接下来的研究中,研究人员使用Notch1信号通路抑制剂DAPT注射到小鼠mPFC中,发现DAPT缓解了METH小鼠的焦虑样症状。下调mPFC神经元Notch1胞内结构域(NICD)还可以缓解METH的相关行为学障碍——认知障碍,抑郁及焦虑表型,并增加其在社交测试中的社交时间。而使用syn-NICD-shRNA和syn-NICD-OE分别抑制和增强mPFC神经元胞内Notch1信号通路的活动可以分别缓解和加剧METH小鼠的焦虑样症状。
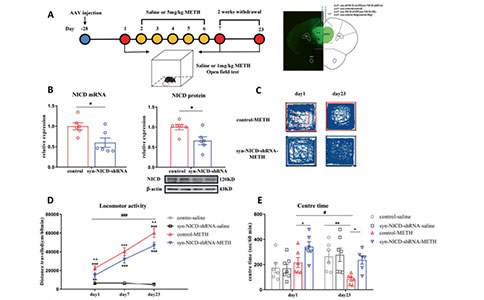
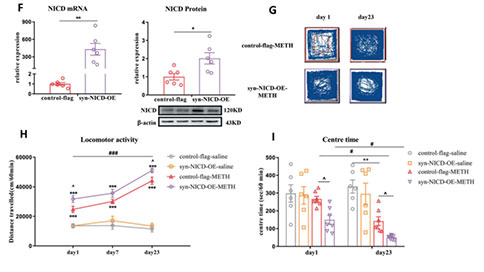
图3:mPFC中Notch1信号的差异化表达能够调节MIP行为
03 mPFC神经元活性的失调是引起MIP的关键因素。为了验证在METH诱导的运动缺陷中,mPFC神经元活性是否与Notch1信号有关,课题组使用shRNA下调了mPFC神经元NICD表达水平,并使用光纤记录技术(瑞沃德光纤记录系统)同步记录mPFC神经元的钙信号:结果显示第1天急性METH给药后钙信号显著下降,而在第23天给药后其钙信号显著下降后短时间内又恢复正常,同时与给药前信号相比显著降低。而当给予生理盐水,急性期及激发期不同组信号均未见明显变化。
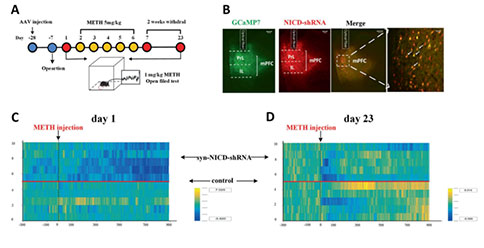

图4:mPFC中NICD的下调可以减弱致敏小鼠的神经元活性
04 METH诱发运动致敏的动物模型伴有抑制性神经递质(GABA等)和兴奋性神经递质(谷氨酸等)的失调,同时Notch1信号与GABA受体和转运体蛋白表达相关。为了验证GABA能系统与Notch1信号调节甲基苯丙胺致敏机制相关,实验结果显示:METH小鼠mPFC中GABA受体和转运体的mRNA表达水平下降,而与急性METH组相比,间歇给药组组GABAAß1、GABAB1和GAT1的mRNA水平显著上调。此外,增强或减弱Notch1信号可分别下调和上调GABAB1受体和转运体的mRNA表达水平。此外,免疫荧光双染检测发现Notch1与GABAB1受体在mPFC细胞中的共表达,表明mPFC中Notch1可能负向调控GABAB1受体的表达。
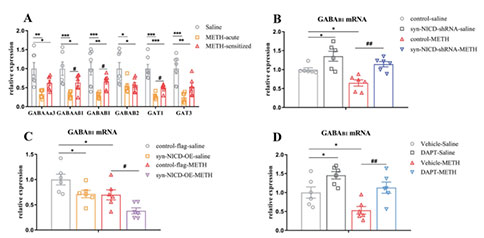
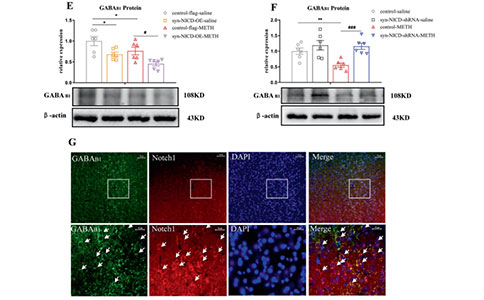
图5:mPFC中Notch1信号负调控GABAB1受体的表达
05 Hes1是Notch1信号的下游转录抑制因子,在神经元中表达并控制GABA能分化。当增强或减弱Notch1信号可分别上调和下调Hes1表达水平,而GABAB1受体水平变化则相反。JASPAR数据库的结果也预测了Hes1在GABAB1启动子上具有3个潜在结合位点。另外ChIP-qPCR结果显示,在GABAB1受体启动子的特异性结合位点(引物3),Hes1明显富集。
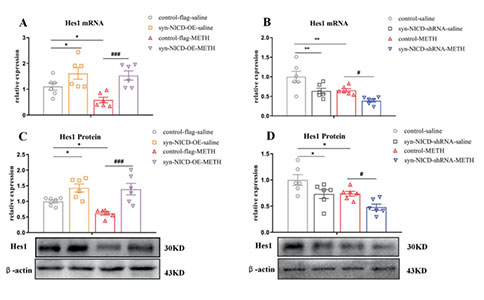
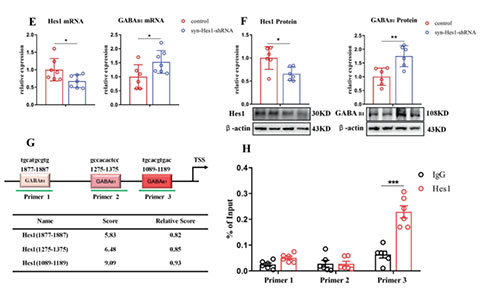
图6:Notch1信号通过Hes1直接调节GABAB1受体的表达
06 最后,研究人员同时调控小鼠mPFC中Notch1和GABAB受体的活性,并测试METH致敏行为。通过phaclofen和baclofen分别抑制和兴奋GABAB受体,可以逆转syn-NICD-shRNA和syn-NICD-OE对METH敏化小鼠的行为学改变。而syn-NICD-shRNA和syn-NICD-OE组中GABAB2受体表达没有变化。
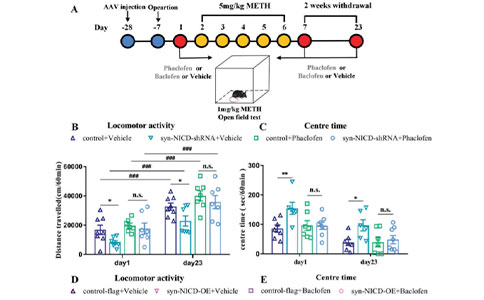
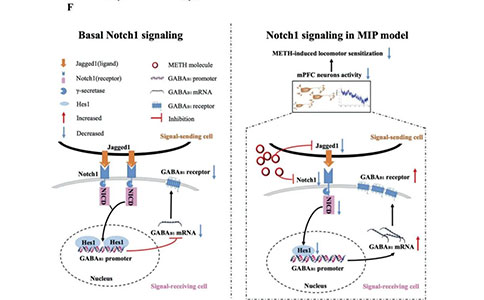
图7:Notch1信号通过GABAB1受体调节METH诱导的运动缺陷
总结
使用METH诱导的啮齿动物运动致敏模型,作者发现在致敏小鼠的内侧前额叶皮层(mPFC)中,Notch1信号下调。Notch1信号转导通过调控mPFC的神经元活动并双向改变METH诱导的运动致敏和其他MIP行为。此外,Notch1信号通路通过Notch1信号通路中的转录抑制因子Hes1负调控甲基苯胺致敏小鼠mPFC中GABAB1受体的表达。同时,作者证明了Hes1可以直接结合GABAB1受体启动子,mPFC中GABAB受体的药理学调节逆转了由Notch1信号转导功能障碍引起的METH诱导的运动致敏的变化。
研究人员的发现揭示了一个之前未被识别的Notch1-Hes1-GABAB1受体依赖机制,该机制涉及MIP中mPFC神经元活动和行为表型的调节,提出了Notch1信号传导与MIP相关的神经可塑性之间的重要关联。这些发现将为MIP的研究提供机制见解,并促进MIP新疗法的开发。
瑞沃德深耕生命科学领域近20年,一直致力于为客户提供可信赖的解决方案和服务,在该项研究工作中,研究者使用了瑞沃德多通道光纤记录系统,相关实验操作得以精确完成。截止目前,瑞沃德产品及服务覆盖海内外100多个国家和地区,客户涵盖全球700+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。