瑞沃德助力2023年第一季度神经科学研究成果集锦
01、学习记忆&认知
Cell:厦门大学王鑫团队揭示认知障碍疾病治疗新靶点
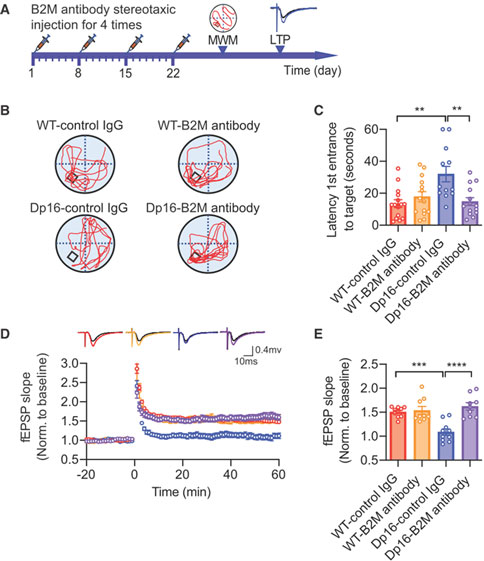
唐氏综合征是智力残疾最常见的原因,与21号染色体异常有关,患者在40岁以后常出现类似阿尔茨海默病的神经病理学特征和症状。除了神经系统功能异常,唐氏综合征患者还表现出各种与免疫相关的症状,包括对感染、自身免疫性疾病、炎症性疾病和恶性血液疾病的易感性增加。目前尚不清楚唐氏综合征外周免疫与中枢神经系统之间是否存在相互作用的病理联系。2023年3月2日,厦门大学医学院王鑫教授团队在《Cell》期刊上发表了题为“β2-microglobulin functions as an endogenous NMDAR antagonist to impair synaptic function”的研究论文,该研究首次证实唐氏综合征患者外周血液中的β2-微球蛋白可以通过血脑屏障进入大脑,并加剧认知损害。中和大脑中升高的β2-微球蛋白可以逆转疾病模型小鼠的认知障碍。该研究揭示了唐氏综合征外周免疫与中枢神经系统病理之间的关联,拓展了领域内对唐氏综合征认知损伤机制的理解,并且为多种认知障碍提供潜在的治疗靶点。
文章原文链接:https://doi.org/10.1016/j.cell.2023.01.021
Nature Biomedical Engineering:暨南大学李晓江/李世华/闫森团队&中国科学院广州生物医药与健康研究院赖良学团队在神经退行性疾病的基因治疗上取得新突破
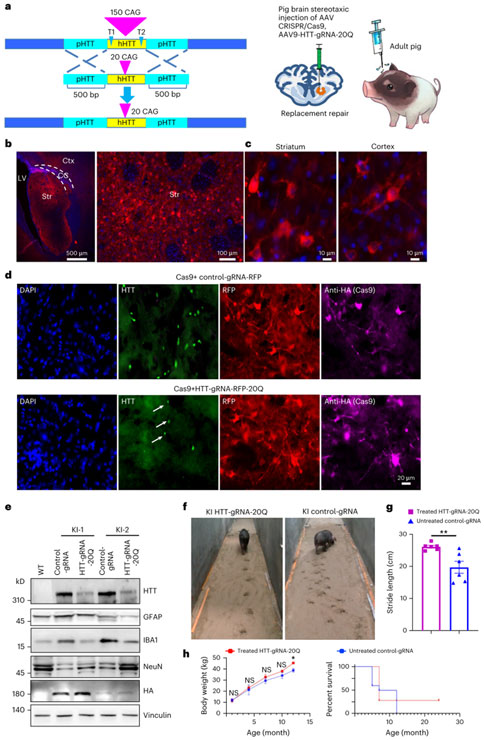
神经退行性疾病,包括阿尔茨海默病、帕金森病、亨廷顿病和肌萎缩侧索硬化症等,均可由基因突变引起。基因治疗对于遗传性疾病,特别是单基因突变导致的神经退行性疾病,具有非常广阔的应用前景。亨廷顿病是常染色体显性并且完全显性的神经退行性疾病,是利用基因编辑工具制作动物模型来研究疾病发病机制和开发疾病治疗策略的理想模型。2023年2月16日,暨南大学粤港澳中枢神经再生研究院李晓江教授/李世华教授/闫森研究员团队联合中国科学院广州生物医药与健康研究院赖良学研究员团队在《Nature Biomedical Engineering》期刊上发表题为“Cas9-mediated replacement of expanded CAG repeats in a pig model of Huntington’s disease”的研究论文。在该研究中,基于团队前期建立的亨廷顿病猪模型,作者利用CRISPR/Cas9基因编辑的技术将变异的亨廷顿基因序列替换为正常人亨廷顿基因序列,首次在大动物模型中证明基因治疗能有效的改善神经退行性疾病的病理特征和行为症状,为神经退行性疾病的治疗提供新的思路。
文章原文链接:https://doi.org/10.1038/s41551-023-01007-3
Molecular Psychiatry:南方科技大学姬生健团队&西南医科大学董伟团队揭示m6A修饰调控记忆形成新机制
海马体是情景事件记忆编码和存储的重要结构,N6-甲基腺苷(m6A)修饰已被证明可以调节小鼠的学习和记忆。但是m6A修饰通过何种阅读器参与海马体的记忆储存以及在其中发挥重要作用的海马体亚区尚不明确。2023年1月20日,南方科技大学生命科学学院姬生健团队联合西南医科大学董伟团队在《Molecular Psychiatry》期刊上发表了题为“YTHDF2 in dentate gyrus is the m6A reader mediating m6A modification in hippocampus-dependent learning and memory”的研究论文。在该研究中,作者通过特异性敲除小鼠海马体不同亚区的m6A阅读器YTHDF1和YTHDF2,证实海马体齿状回中的YTHDF2是唯一能够单独影响记忆产生的m6A阅读器。该研究加深了业内对于m6A修饰在记忆形成中作用的认知,极大地拓宽了神经发育和记忆认知相关研究的视野。

文章原文链接:https://doi.org/10.1038/s41380-023-01953-z
02、精神情感障碍
Cell:南方医科大学朱心红团队揭示心理弹性调控的神经环路机制
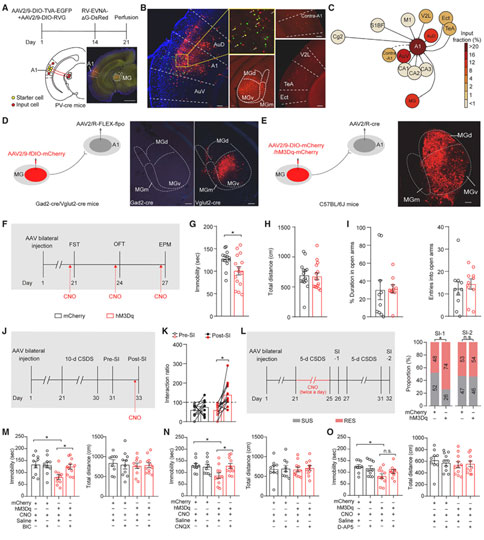
重度抑郁症是导致残疾的主要原因,影响了全球约3.22亿人。尽管在过去的几十年里,抑郁症的研究和治疗开发取得了重大进展,但由于对抑郁症神经机制的认识不足,导致一半以上的患者没有得到足够的治疗。在面对压力和创伤时,大多数人能够快速恢复,只有一小部分人会迅速发展为严重抑郁,甚至有相当一部分抑郁症患者也会自我康复。然而这种自我恢复潜在的神经生物学机制目前并不明确,揭示这一机制有望带来更有效的抑郁症预防策略和治疗方法。2023年3月30日,南方医科大学朱心红教授团队在《Cell》期刊上发表了题为“ A thalamic-primary auditory cortex circuit mediates resilience to stress”的研究论文。在该研究中,作者发现了一个对抗应激压力并介导自我恢复的微环路:来自同侧内侧膝状体(medial geniculate, MG)的丘脑输入激活初级听觉皮层(primary auditory cortex, A1)的小清蛋白(parvalbumin, PV)中间神经元对小鼠暴露于慢性社会挫败应激后的自我恢复至关重要。慢性社会挫败的早期刺激会诱导自我恢复的小鼠大脑中投射到A1 的MG神经元(MGA1)短期超极化,并通过突触前的BDNF-TrkB信号启动丘脑PV神经元的突触发生。此外,模拟MGA1神经元的短期超极化可在多种动物模型上引起长效抗抑郁样效应,为未来抑郁症的治疗提供新的策略和靶点。
文章原文链接:https://doi.org/10.1016/j.cell.2023.02.036
Immunity:中科院昆明动物研究所赖仞团队揭示压力促进抑郁新机制
慢性压力能够引起去甲肾上腺素能神经元过度激活,诱导神经元退行性病变,并引起蓝斑神经元功能障碍。压力诱导的中枢去甲肾上腺素能系统失调与抑郁症的发病机制有关,单胺类假说认为脑内单胺不足是抑郁症发生的重要因素,但其机制尚不清楚。2023年2月27日,中国科学院动物研究所赖仞团队在《Immunity》期刊上发表题为“Lipopolysaccharide-binding protein expression is increased by stress and inhibits monoamine synthesis to promote depressive symptoms”的研究论文,该研究发现,长期性应激压力(如社交失败、慢性发炎等)能够显著上调脂多糖/内毒素结合蛋白(lipopolysaccharide-binding protein, LBP)的表达水平并抑制单胺类递质(如5羟色胺、多巴胺、去甲肾上腺素)的合成,从而促进了抑郁症状的形成。该研究揭示了LBP在调节单胺生物合成中的重要作用,并提示靶向LBP有可能作为一种有潜力的抑郁症治疗的方法。
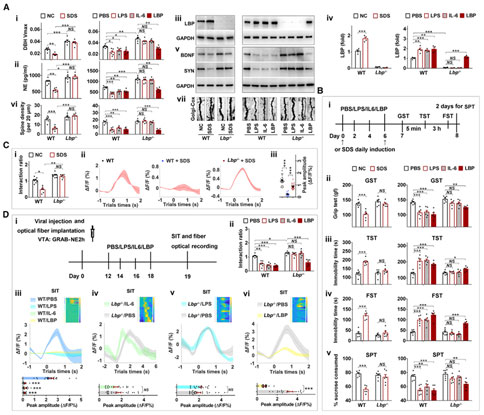
Cell:浙江大学胡海岚团队揭示社会地位下降导致抑郁的神经机制
社会地位下降是抑郁症众所周知的风险因素。在人类社会中,社会地位降低会使男性抑郁的风险增加3~4倍。在动物中,社会地位的丧失会促发猴子或黑猩猩的抑郁样行为,地位较低的家养母鸡也表现出轻度抑郁样行为,即便是蜥蜴或鱼类,失去等级或领地也可能导致抑郁样行为。由于缺乏合适的动物模型,这一现象的神经机制目前仍然难以确定。2023年1月24日,浙江大学胡海岚教授团队在《Cell》期刊上发表题为“Neural Mechanism Underlying Depressive-Like State Associated with Social Status Loss”的研究论文。该研究基于非暴力的社会竞赛(钻管实验),建立了社会等级丧失诱导抑郁样行为的动物模型。利用该模型,作者揭示了社会地位下降导致抑郁症的神经环路机制:社会地位下降会触发负性奖赏预测误差,从而激活大脑中的反奖赏中枢外侧缰核;而外侧缰核的激活,既能诱导抑郁样行为,还能抑制负责调控社会竞争力的内侧前额叶皮层,进一步降低小鼠的竞争能力。该研究揭示了社会地位下降和抑郁样行为之间相互促进的核心神经机制,并为社会竞争压力导致的抑郁症提供了预防和治疗的新见解。

文章原文链接:https://doi.org/10.1016/j.cell.2022.12.033
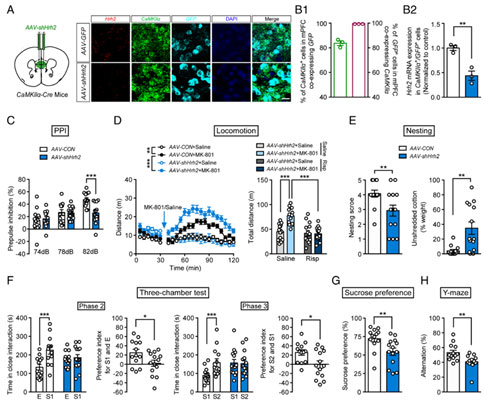
PNAS:浙江大学胡薇薇/陈忠团队发现精神分裂症药物治疗新靶点
精神分裂症是一种严重的精神障碍,主要表现为幻觉、妄想和行为紊乱等阳性症状,或者社交退缩、快感缺失、失语症和情感迟钝等阴性症状,以及认知缺陷。现有抗精神病药物的疗效有限并有很强的副作用。谷氨酸能神经元及其受体功能异常被认为是精神分裂症发病的重要因素,因此探究谷氨酸相关的神经机制可能有助于精确药物作用靶点的开发。组胺在大脑中的功能主要是由组胺H1受体介导,然而对于H2受体(H2R)的作用,尤其是在精神分裂症中,目前尚不清楚。2023年2月22日,浙江大学基础医学院胡薇薇教授和药学院陈忠教授团队在《PNAS》期刊上发表了题为“Histamine H2 receptor deficit in glutamatergic neurons contributes to the pathogenesis of schizophrenia”的研究论文。该研究发现小鼠前额叶皮层谷氨酸能神经元上H2R缺失后,HCN通道介导的电流增加,谷氨酸能神经元的兴奋性降低,继而引起小鼠产生精神分裂症样表型。该研究为精神分裂症的谷氨酸假说提供了证据,为揭示谷氨酸能神经元H2R在精神分裂症中的重要作用提供了依据,并且为精神分裂症的治疗提供了潜在的精确药物作用靶点。
文章原文链接:https://doi.org/10.1073/pnas.2207003120
03、代谢&稳态
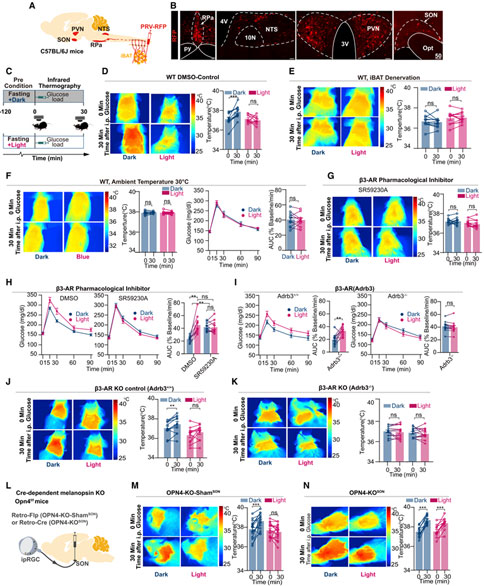
Cell:中国科学技术大学薛天团队揭示光调控血糖代谢的神经机制
对于地球上的生命来说,光是最重要的环境因素之一,人造光源是糖尿病、肥胖等代谢性疾病的高危因素。通过改变光照模式来打乱昼夜节律可以影响代谢,然而,光照是否能够直接调控血糖代谢目前仍不清楚。2023年1月20日,中国科学技术大学生命科学与医学部薛天教授团队在Cell期刊上发表了题为Light modulates glucose metabolism by a retina-hypothalamus-brown adipose tissue axis的研究论文。该研究发现光照可以激活视网膜自感光神经节细胞,经下丘脑视上核-室旁核-孤束核-中缝苍白核的多级神经环路,能够抑制支配棕色脂肪组织的交感神经活动,从而抑制机体的血糖代谢能力,导致血糖上升。该研究揭示了光感知抑制棕色脂肪组织的产热来影响血糖代谢的神经机制,提示健康生活应该关注适宜的光线环境,并且为人造光源引起的代谢失调提出了一种潜在的预防和治疗策略。
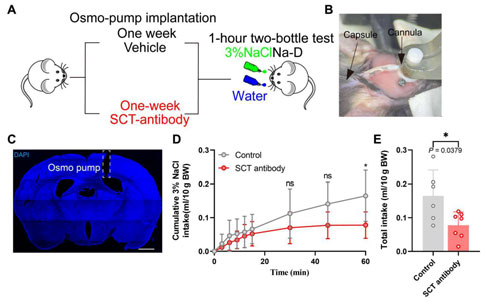
Science Advances:暨南大学张力/师玲玲团队&香港大学Billy Kwok Chong Chow课题组揭示调控钠稳态的肠-脑轴机制
水盐平衡对陆生动物的生存至关重要,哺乳动物可以通过神经环路和激素因子来维持体内钠稳态。钠的吸收主要发生在富含钠通道的胃肠道,然而胃肠道是否能够调节体内钠水平目前仍不清楚。2023年2月16日,暨南大学粤港澳中枢神经再生研究院的张力/师玲玲团队联合香港大学Billy Kwok Chong Chow课题组在《Science Advances》期刊上发表了题为“A gut-brain axis mediates sodium appetite via gastrointestinal peptide regulation on a medulla-hypothalamic circuit”的研究论文,该研究发现,机体缺钠时,胃肠道胰泌素释放肽(gastrointestinal peptide secretin, SCT)会从结肠内分泌细胞中释放出来,并跨越血脑屏障,激活脑内孤束核胰泌素受体表达神经元,并进一步激活下丘脑下游脑室旁核,从而增加钠的摄入欲望。该研究揭示了一条能够快速调节机体钠稳态的肠-脑通路,为理解钠稳态的控制提供了新见解,并为纠正体内钠失衡提供了潜在靶点。
文章原文链接:https://www.science.org/doi/10.1126/sciadv.add5330