下丘脑调控成年海马新生神经元改善AD认知情感障碍
下丘脑调控成年海马新生神经元改善AD认知情感障碍
阿尔兹海默病(AD)是一类以认知情感损害为主要行为表现的严重神经退行性疾病。通过调控成年海马神经发生(AHN)以改善AD认知情感损害的有效性存在争议。近日,北卡罗来纳大学教堂山分校(UNC)宋娟课题组博士后李亚东(现为上海交通大学医学院松江研究院研究员)、罗艳佳(共同第一作者,现为上海交通大学医学院第九人民医院研究员)等在调控成年海马新生神经元改善AD认知情感障碍方向取得重要研究进展,相关成果于4月6日以‘Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer's disease’为题在《Cell Stem Cell》以Article形式发表。
近年来,通过调控海马神经发生改善AD认知情感损害一直是研究热点。已有研究使用基因调控策略,干预AHN的不同基因在拯救海马新生神经元改善记忆的效果上存在明显差异,且对于神经发育的动态过程描述不清。不同于基因操控,靶向神经环路可以实现对AHN不同阶段的精准调控。李亚东博士等前期报道已证实刺激下丘脑觉醒核团SuM促进空间记忆,增加海马新生神经元数量及成熟度并对抗焦虑样行为。那么操控SuM环路能否改善AD小鼠的神经发生正是本篇文章的研究重点。
01. 5×FAD小鼠的海马神经发生受损早于行为缺陷发生
通过染色及谱系追踪方法证实AHN损伤始于3.5月龄5×FAD小鼠,此时仅神经前体细胞的增殖受到影响,但并未导致ABN生成减少。使用行为学(新位置识别,条件恐惧,旷场,O迷宫,强迫游泳)测试3.5月龄和4.5月龄的5×FAD小鼠的海马依赖性记忆表现和情绪状态,以确定这些行为发生受损的时间。结果表明4.5月龄(而非3.5月龄)5×FAD小鼠的记忆受损,焦虑和抑郁样行为增加。但是使用化学遗传学激活ABN并不能挽救5×FAD小鼠的行为缺陷。
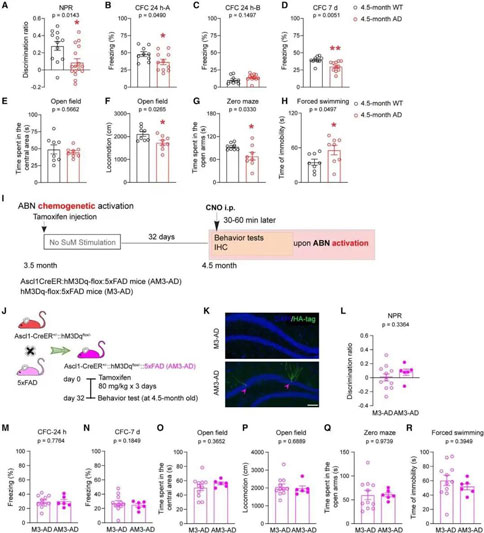
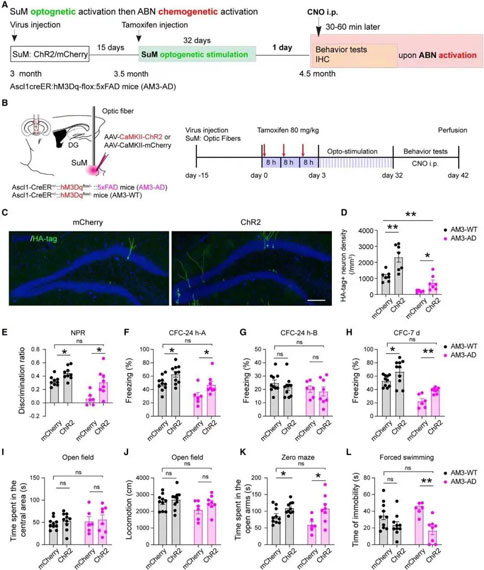
02. 模式光遗传刺激SuM可促进5×FAD小鼠海马神经发生,并不改善记忆情感功能
针对化学遗传学并未改善AD小鼠行为缺陷可能是因为AD小鼠的ABN数量降低且功能受损。因此,研究人员采用的第二项方案便是增加ABN的数量。研究团队使用光遗传学法(optogenetics)刺激3.5-5个月大AD小鼠的SuM,成功促进了AHN,ABN的数量和突触连接均得到改善。但遗憾的是,AD小鼠的记忆情感功能并未明显提高。
使用c-fos染色及光纤记录方法(RWD光纤记录系统)检测5×FAD小鼠中DG投射SuM神经元的活性,课题组发现在4.5月龄(而非3.5月龄)5×FAD小鼠中DG投射SuM神经元的c- Fos表达和Ca2+活性显著降低。在4.5月龄的ChR2-AD小鼠中,慢性模式光遗传刺激SuM导致细胞密度显著增加,同时树突棘密度显著增加。在ChR2-AD小鼠的CA3亚区中,ABN的苔藓纤维轴突显著增加,表明SuM增强了ABN与CA3神经元之间的连接。但行为学测试中,AD小鼠的记忆情感功能并未明显提高。

03. 激活SuM增强的ABN可改善5×FAD小鼠的行为缺陷
既然激活受损的ABN或者单纯增加ABN数量,均不足以改善AD小鼠记忆情感功能。于是研究人员将二者综合,综合调控ABN数量、成熟度和活性,以最大程度实现对记忆情感功能的调控。研究团队首先通过光遗传学刺激4.5个月AD小鼠的SuM,增加ABN数量和成熟度;而后使用化学遗传学激活SuM环路修饰的ABN,增加其活性。结果显示,小鼠的空间记忆损害和抑郁样行为均得到改善,并恢复至健康小鼠的水平。
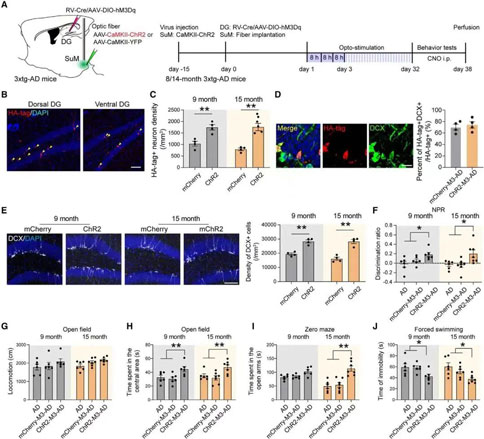
04. 激活SuM增强的ABN可逆转老龄3×Tg-AD小鼠的行为缺陷
鉴于5×FAD小鼠出现Aβ沉积的时间较早,此类小鼠模型中缺乏对AD至关重要的衰老因子。为了解决这一问题,课题组使用了另外一种AD小鼠模型3× Tg-AD,该模型的AD病理进程比5×FAD小鼠慢得多。同样发现光遗传学刺激可增加ABN数量和成熟度,化学遗传学激活SuM环路修饰的ABN改善了小鼠的空间记忆损害和抑郁样行为,并且不影响运动。
05. 5×FAD小鼠中SuM增强ABN激活介导的信号机制
为了探究激活SuM环路修饰的ABN改善记忆和情感的神经环路和分子机制。作者采用磷酸化蛋白质组学发现SuM刺激的ChR2-AM3-AD小鼠的磷酸化水平发生了改变,但总体蛋白水平没有显著改变。对SuM增强的ABN进行急性刺激后,与突触可塑性相关的通路显著激活,例如长时程增强(long-term potentiation, LTP)、CREB信号传导和突触发生,此外小胶质细胞吞噬斑块相关的通路也显著激活。
在海马的各个亚区中,上述通路中几种关键蛋白的磷酸化水平会在其中的齿状回、CA3和CA1区发生不同程度的改变。进一步的功能检验指出,激活SuM环路修饰的ABN可能通过改变海马突触可塑性、神经元活性改善AD认知情感功能,同时促进小胶质细胞吞噬淀粉样斑块的作用。
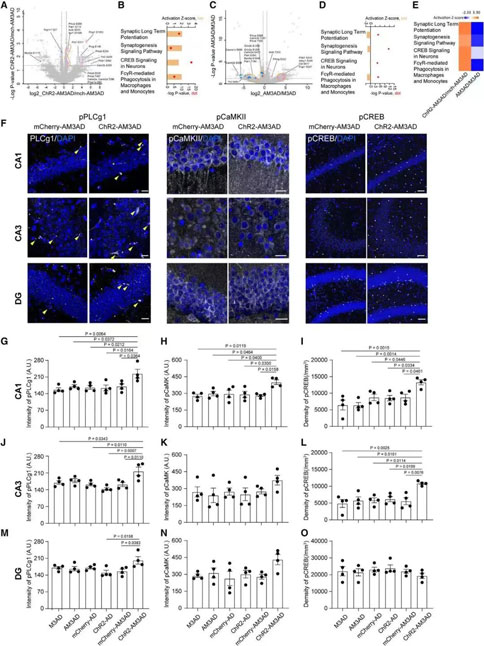
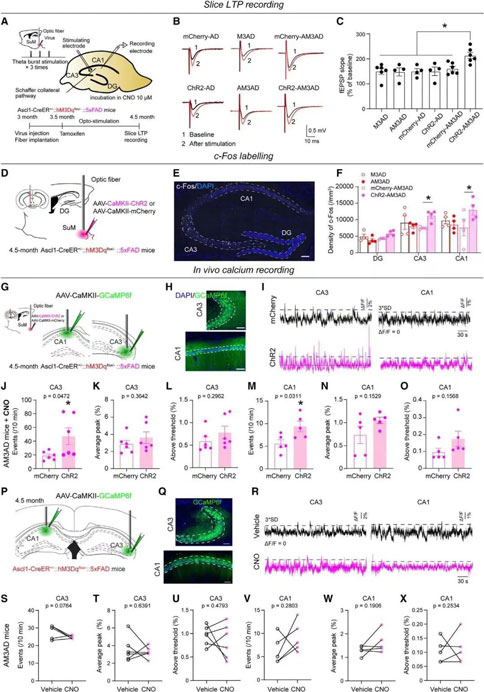
06. SuM增强的ABN的激活增加了AD小鼠CA3和CA1活性
为了对CA1的突触可塑性进行功能验证。通过膜片钳技术记录海马LTP,在ChR2-AM3-AD小鼠中,通过CNO处理的ABN的急性化学遗传激活导致了CA1 LTP的显著增加。结合蛋白组学的数据,神经元中CREB信号的激活,促使作者思考激活SuM增强的ABN是否会改变局部海马环路的活动。通过c-Fos染色及光纤记录(研究使用到RWD光纤记录系统)证实SuM增强的ABN激活增加了海马CA3和CA1(而不是DG)的活性。
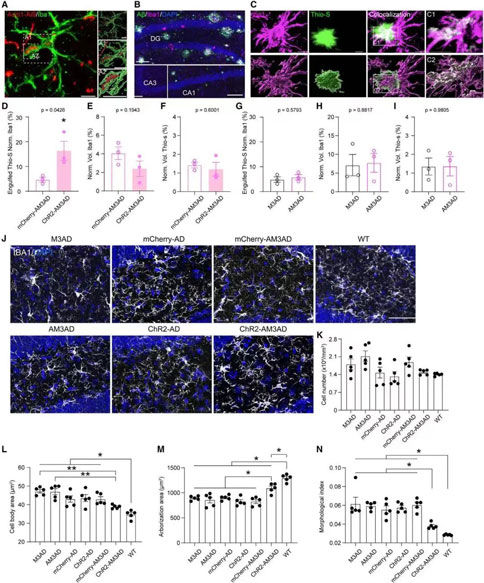
07. 在5×FAD小鼠中,SuM增强的ABN的激活增加了小胶质细胞对斑块的吞噬
通过Imaris成像分析,SuM增强ABN的急性化学遗传激活后提高了小胶质细胞对斑块的吞噬作用,SuM增强的ABN的急性激活显著降低了小胶质细胞的体细胞面积,增加了突起的分支,并降低了形态学指数。这些结果表明,在AD小鼠中,SuM增强的ABNs的激活促进了小胶质细胞对斑块的吞噬并改善了小胶质细胞的形态。
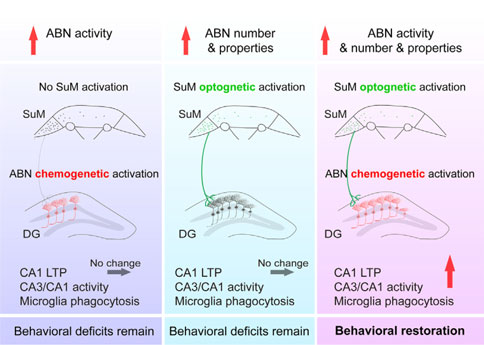
在本研究中,研究人员发现在AD小鼠模型中,模式性光遗传刺激SuM可增强AHN。SuM环路修饰的ABN的化学遗传激活可改善AD小鼠的记忆和情绪缺陷。而单独的SuM刺激或激活非SuM环路修饰的ABN不能恢复AD小鼠的行为缺陷。此外,定量磷酸化蛋白质组学分析揭示了与之产生变化的突触可塑性和小胶质细胞吞噬相关的经典通路。此项研究证实了SuM增强的ABN在调节AD相关缺陷中的贡献,仅激活一小部分新生神经元(ABN) 活性,就足以恢复AD相关的认知和情感缺陷;并揭示了由SuM增强的ABN激活介导的信号机制,在AD治疗的分子机制上提供了潜在的蛋白靶点,为临床转化和药物开发提供方向。








相关推荐
评论列表共有 0 条评论
暂无评论
发表评论
取消回复