西湖大学贾洁敏团队揭示神经元和脑血管的直接对话机制
有130年历史的代谢假说解释了NVC,但这一假说越来越有争议,最近发现细胞类型特异性和神经递质介导的机制是调节CBF的主要机制。然而,这种神经信使传递特异性的分子和细胞机制在很大程度上仍然未知,活跃的神经信息如何传递到脑内的目标微动脉仍不清楚。
2024年1月2日,西湖大学贾洁敏团队在Nature Neuroscience期刊上发表题为Synaptic-like transmission between neural axons and arteriolar smooth muscle cells drives cerebral neurovascular coupling的研究论文,该研究证实单个谷氨酸能神经元轴突通过神经-小动脉平滑肌细胞(arteriolar smooth muscle cells, aSMCs)连接之间的突触样传递来扩张其支配的小动脉。这一发现揭示了神经元与脑血管直接对话的一座“新桥梁”,也为理解脑血流的快速和精准调控提供了一个全新的认知。

结果表明,星形胶质细胞终足对穿支动脉的包裹率并不是100%,反而存在“漏洞”。血管周围神经元轴突的子突触前会穿过这些漏洞,插入aSMCs外围的基底膜,与aSMCs形成“类突触”(neural–arteriolar smooth muscle cell junctions, NsMJs)。这一结构为神经元与血管之间的对话提供了一座前所未见的“新桥梁”。
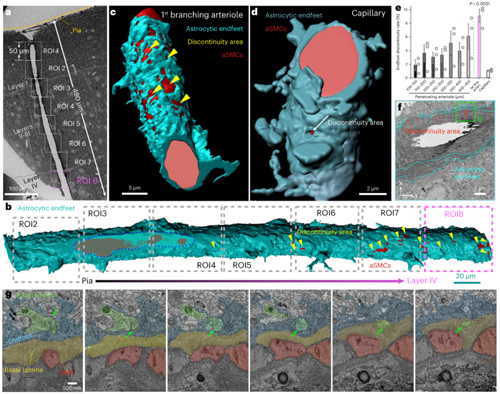
为了证实NsMJs是否真正承担了信息传递功能,研究团队首先检测了aSMCs是否具有接收神经递质信号的接收器。结果显示,脑内aSMCs能表达多种神经递质受体,其中就包括通透钙离子的谷氨酸神经递质的受体NMDAR。随后作者通过激活NsMJs的突触前膜来确认神经元分泌的神经递质是否可以与aSMCs上的神经递质受体结合,从而调节血管的舒张或者收缩。研究团队开创了颅内单根轴突和树突光遗传学激活技术,并且同时跟踪靶向动脉的直径变化。特异性激活类突触前的单个谷氨酸能神经元轴突,可以诱发动脉血管舒张,直径增大近15%。进一步,通过经典胡须刺激实验,研究团队观察到破坏Glu-NsMJ的信息传递能够显著抑制NVC(该实验用到了瑞沃德生产的激光散斑血流成像系统)。这些结果证明NsMJs可调节大脑血管收缩舒张。
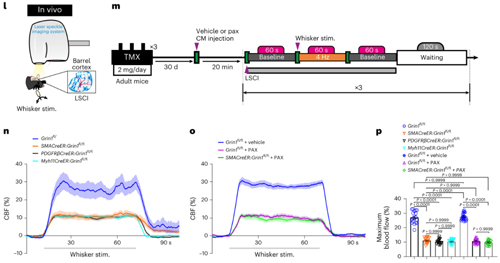
上述结果证实了神经元直接调节大脑血流的全新路径,那么这一路径在脑血管性疾病中是如何发挥调节作用的呢?研究团队基于小鼠大脑中动脉闭塞(middle cerebral arterial occlusion, MCAO)模型做了进一步的探讨。在MCAO造模后的急性缺血期,在高浓度谷氨酸刺激下,aSMCs会大量去极化,导致血管急性收缩,造成二次缺血;而通过特异性敲除aSMCs上NMDAR受体的GluN1亚基,可以缓解动脉毒性以及后续的脑萎缩程度,增强小鼠的运动功能恢复并降低死亡率。
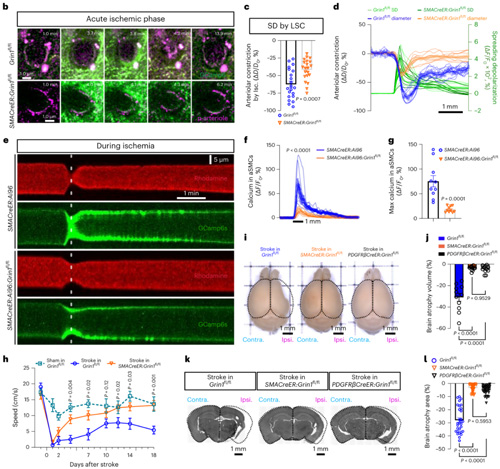
综上,该研究证实了大脑中神经元与脑血管之间存在一种“类突触(NsMJs)”结构,该结构能够在生理和病理条件下调节大脑血管的舒张和收缩,为神经元和脑血管的直接对话架起了一座“新桥梁”。这些发现为深入理解大脑的血供机制提供了新的视角,并为脑卒中的治疗提供了新的思路。
研究方法与亮点
这项工作揭示了神经元调控大脑血流新路径。研究用到了动物手术造模、大体积三维扫描电镜、光电联合,钙成像、电生理记录、双光子光遗传学、动物微循环血流成像分析、免疫组化以及动物行为学等实验技术。
瑞沃德深耕生命科学研究领域21年,一直致力于为客户提供可信赖的解决方案和服务。在该研究中,研究人员采用了瑞沃德生产的激光散斑血流成像系统,为实验的顺利开展提供了支持。此外,瑞沃德还可提供该研究所涉及的动物手术造模、钙成像、电生理记录、免疫组化以及动物行为学等实验技术的完整解决方案。
截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球2300+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。