北大李毓龙课题组构建一种全新的ATP荧光探针
文章概述
三磷酸腺苷(Adenosine 50-triphosphate,ATP)是一种广泛存在于体内的能量存储分子。除了参与细胞内的能量代谢功能外,越来越多的证据表明,释放到细胞外空间的ATP可以作为一种分子信号(嘌呤能递质),能够结合并激活离子型P2X受体以及代谢型P2Y受体。在神经系统中,释放的ATP参与了多中生理病理过程,包括痛觉感受、机械/化学感知信号转导、突触传递、损伤、炎症等。对于ATP在这些生理过程中的作用,目前的研究并未完全阐明。
为了进一步研究ATP的生理功能,2021年12月22日,北京大学生命科学学院李毓龙教授团队发表在《Neuron》期刊上发表题为“A sensitive GRAB sensor for detecting extracellular ATP in vitro and in vivo”的研究论文,该项工作展示了团队最新开发的一种可遗传编码的荧光分子探针——GRABATP1.0(简称ATP1.0;GRAB:G protein-coupled receptor activation-based sensors),该探针以P2Y受体作为ATP的结合支架,能够对细胞外的ATP进行高灵敏度、高选择性以及高时空分辨率的实时测量。该项工作是李毓龙教授团队在相继开发了乙酰胆碱、多巴胺、去甲肾上腺素、血清素和腺苷等一系列分子探针之后的后又一重要成果,对于我们深入研究并理解ATP的生理功能具有重要意义。

核心观点
2、ATP1.0对于细胞外ATP具有高敏感性和高时空分辨率;
3、ATP1.0可用于离体以及在体ATP释放的实时监测。
研究结果分析
1. ATP1.0表现出卓越的细胞外ATP检测性能
为了开发一个遗传编码的ATP荧光探针,研究者首先系统地筛选了能够被ATP激活的G蛋白耦合受体(G protein-coupled receptors, GPCRs),包括人源的P2Y1、P2Y2、P2Y4、P2Y11、P2Y12和P2Y13等。以这些GPCRs作为支架,研究者将结构敏感的绿色荧光蛋白(circularly permuted enhanced GFP, cpEGFP)插入到这些受体结构中。其中hP2Y1在插入cpEGFP后表现出最佳的膜转运和对ATP的响应性,因此随后研究者选择了基于hP2Y1的嵌合体ATP0.1进行进一步优化,并且最终得到了对ATP荧光响应性最好的ATP1.0。当ATP1.0在HEK293T细胞中表达时,它能够很好的被运输到细胞膜上表达,并对细胞外100mM的ATP产生一个~500%的dF/F0峰值。在特异性方面,ATP1.0对细胞外ATP的反应能够被P2Y1的拮抗剂MRS-2500阻断。ATP1.0对其它递质不会产生反应,包括谷氨酸、GABA、甘氨酸、多巴胺、去甲肾上腺素、血清素、组胺和乙酰胆碱等,对二磷酸腺苷(Adenosine Diphosphate, ADP)的反应与ATP类似,但是对于其它结构类似的嘌呤能分子或衍生物,如一磷酸腺苷、腺苷、二磷酸尿核苷等几乎不产生反应。ATP1.0的反应具有快速动力学的特征,其反应平均上升时间常数约为28 ms,平均衰减时间常数约为283 ms。在荧光强度上,ATP1.0被ATP激活时的亮度达到了直接表达hP2Y1-EGFP融合蛋白荧光强度的64%,并且ATP1.0在单光子激发下的光谱与EGFP相似,激发峰在500 nm,发射峰在520 nm。在与其它细胞外ATP分子探针的比较中,ATP1.0表现出更大的动态检测范围、更强的荧光反应、以及更低的信噪比。
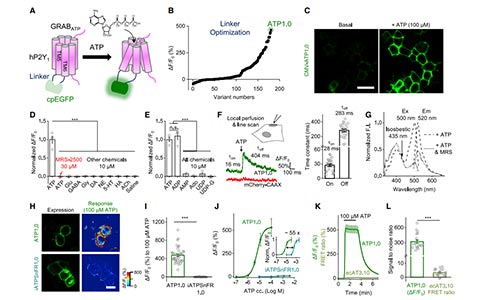
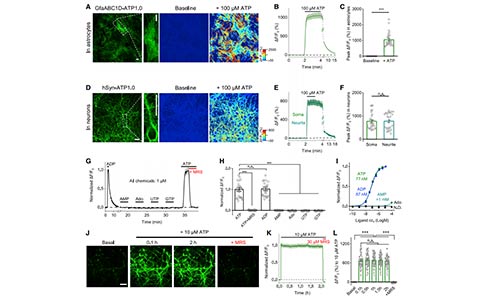
接下来,研究者探讨了ATP1.0在原代培养的星形胶质细胞和神经元中的表达能力以及反应性。ATP1.0能够广泛的表达到星形胶质细胞和神经元的细胞上,包括胞体、突起等部位。表达到星形胶质细胞和神经元上的ATP1.0对细胞外ATP均有较好的反应,其平均dF/F0峰值分别约为1000%和780%。此外,ATP诱导的荧光反应也能够被P2Y1、受体拮抗剂MRS-2500阻断。此外,与HEK293T中结果相似,神经元中表达的ATP1.0对ATP和ADP均有反应,但对一磷酸腺苷、腺苷、二磷酸尿核苷均无反应。更重要的是,ATP1.0在细胞表面非常稳定,在给予10mM 的ATP 两小时后,表达ATP1.0的神经元的荧光没有出现明显下降。综上所述,ATP1.0能够适用于多种类型的细胞,对细胞外的ATP产生高灵敏度、高选择性和高稳定性的荧光增强反应。
2. ATP1.0可用于监测体外培养细胞外的ATP水平
接下来,研究者测试了ATP1.0是否能够用于检测神经-胶质共培养细胞中内源性ATP的释放。在大脑中,机械刺激和细胞肿胀均能诱发胞内ATP被释放。在表达ATP1.0的细胞中,给予细胞机械刺激(利用玻璃微电极按压某个细胞),能够引起一个快速、局部增强的dF/F0信号,反映了ATP的释放。为了诱导细胞肿胀,研究者将细胞浸泡在低渗溶液(130 mOsm/kg)中;在1min内,dF/F0信号显著增加。并且在应用MRS-2500后,这两种刺激引起的反应都被完全抑制。研究者还发现,低渗刺激诱导的ATP释放可能不需要依赖经典的SNARE囊泡释放机制,因为细胞表达了破伤风毒素轻链(tetanus toxin light chain, TeNT,可以切割突触短肽并阻止胞外分泌过程),但是对低渗刺激诱导的反应没有影响;而作为对照,表达TeNT阻断了低渗刺激诱发的谷氨酸释放。除了刺激诱发的ATP释放外,研究者还观察到,即使在没有外部刺激的情况下,神经-胶质共培养细胞中也存在自发、局部、以及短暂的ATP1.0信号。在1.6mm2成像视野中,这些自发事件以1.2次/min的速率出现,其dF/F0的平均峰值约为210%。ATP自发释放的平均上升时间约为11s,衰减时间约为43s,其释放范围的平均直径约为32mm。为了确保ATP1.0信号反映了细胞外的ATP动态变化,研究者利用三磷酸腺苷双磷酸酶(ATP的水解酶)对细胞进行处理并成像,观察到三磷酸腺苷双磷酸酶能够显著阻断自发事件的发生。与以前的检测手段相比,ATP1.0具备更高的灵敏度,能够在普通条件下特异性的检测ATP的释放。
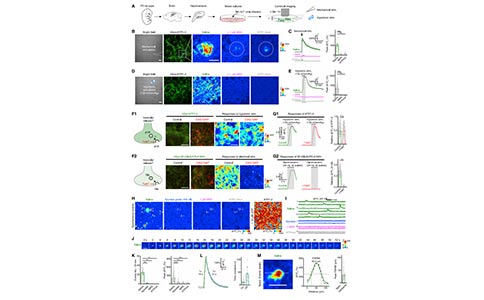
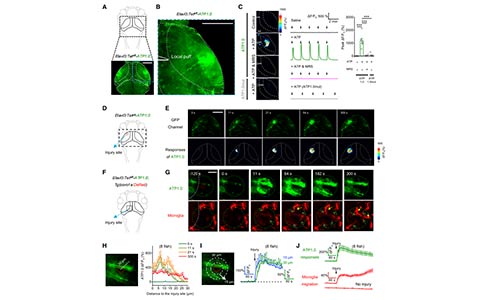
3. ATP1.0可用于监测斑马鱼幼体中ATP的动态变化
在证明了ATP1.0可用于体外ATP的检测后,研究者接着探讨了它是否可以用于监测体内(如斑马鱼中)ATP的动态变化。在斑马鱼幼体神经元中特异性地表达ATP1.0后,利用ATP局部处理会引起视顶盖中dF/ F0信号出现强烈的瞬时增加,这些信号能够被MRS-2500阻断。在验证了ATP1.0能够对外源ATP做出反应后,研究者进一步探讨了ATP1.0是否能够用于检测活斑马鱼内源性ATP的释放。ATP信号在促进小胶质细胞向损伤部位迁移中发挥关键作用。在表达ATP1.0的斑马鱼中,研究者发现激光消融诱导视顶盖损伤后会导致荧光增强,其反应从损伤部位向外呈放射状传播。损伤后11s和64s释放ATP的范围,其平均直径分别为~23mm和~34mm。接下来,研究者通过在斑马鱼的视顶叶中表达ATP1.0,同时监测ATP的释放和小胶质细胞的迁移,斑马鱼的小胶质细胞用红色荧光蛋白DsRed标记。研究者们发现,在激光消融后,小胶质细胞沿着ATP传播路径逐渐迁移到损伤部位。因此,ATP1.0非常适用于活体斑马鱼幼虫ATP监测,并且具有较高的时空分辨率。
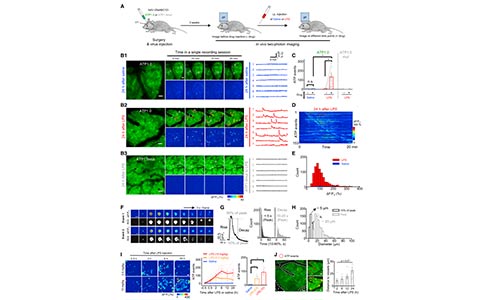
4. ATP1.0可用于监测小鼠全身炎症引起的ATP局部释放
ATP是应对机体急慢性炎症反应的关键细胞外信使,但是在全身炎症期间ATP释放的模式还不清楚。研究者在小鼠腹腔注射细菌脂多糖(lipopolysaccharides, LPS)诱导全身炎症,并通过双光子显微镜来观察直接观察视觉皮层ATP1.0的荧光反应。注射LPS 24小时后,研究者观察到皮质内多次ATP局部释放事件,在记录的20min内,其发生频率约为5 – 10次/min。在星形胶质细胞中,ATP释放的上升时间相对较快(<5s),衰减时间较慢(10-20s)。此外,ATP的释放具有空间选择性性,信号的平均直径(根据每个事件的最大直径确定)约为9.9mm,小于典型星形胶质细胞的平均直径(10-20mm)。为了研究ATP释放与炎症进展之间的相关性,研究者记录了注射不同剂量LPS(分别为0.5和10 mg/kg)后不同时间点的皮质ATP释放情况。研究者发现,在注射LPS后30 min内,ATP释放均有所增加,且释放次数随时间逐渐增加,并分别2h和6h时达到顶峰。对ATP释放的位置分析显示,早期ATP释放发生在相对靠近血管的地方,随后释放距离逐渐增加。这些数据表明,大脑可以感知炎症,并以具有空间选择性的ATP释放的形式做出反应,这些结果表明ATP1.0适用于小鼠在体成像,同时兼备高灵敏度和高时空分辨率。
总结
该研究报道了一种全新的基因编码的ATP荧光探针——ATP1.0,该探针能够高灵敏度地检测脑组织中ATP的动态变化。ATP1.0可以在多种类型细胞中稳定表达,包括细胞系、星形胶质细胞和神经元,为测量细胞外ATP提供了可靠的工具。此外,利用ATP1.0可以实现体外及在体ATP释放的可视化实时监测。

亮点研究方法