脊髓神经元调控伤害性热刺激感受新机制
文章概述
对人来说,皮肤温度高于43℃会引起急性疼痛,长时间暴露于伤害性热刺激中会造成组织损伤,并破坏体温的动态平衡。脊髓背角神经元在处理和传递来自背根神经节(Dorsal Root Ganglion, DRG)痛觉传入纤维的感觉信号中起着关键作用,但是,伤害性热刺激信号在脊髓中的处理过程尚不清楚。2022年5月12日,美国凯斯西储大学医学院的研究人员在《Neuron》杂志上发表题为“A novel spinal neuron connection for heat sensation”的文章,该研究证实了由脊髓ErbB4+(ErbB4,一种表皮生长因子受体家族的酪氨酸激酶受体)神经元能够通过NRG1-ErbB4信号通路来调控机体对伤害性热刺激的感受,揭示了脊髓中一个新的伤害性热刺激感受的调控机制。

核心观点
1、脊髓ErbB4+神经元能够被伤害性热刺激所激活;
2、脊髓ErbB4+神经元受TRPV1+伤害感受器的单突触神经支配;
3、消融或抑制ErbB4+神经元会降低动物对伤害性热刺激的感受;
4、同时抑制脊髓中ErbB4+、SST+和CCK+神经元能够进一步降低伤害性热刺激的感受;
5、NRG1-ErbB4信号通路能够促进伤害性热刺激的感受和热痛过敏反应。
研究结果分析
1. 伤害性热刺激能够激活脊髓中ErbB4+兴奋性神经元
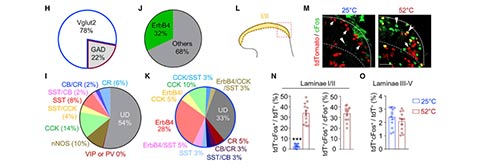
为了识别对伤害性热刺激产生反应的神经元,作者利用了EGFP表达依赖于内源性cFos启动子的cFos::shEGFP小鼠。当cFos::shEGFP小鼠受到伤害性热刺激(52℃热板)时,脊髓背角神经元中的shEGFP表达增加,大量的shEGFP+神经元位于脊髓背角表层(Ⅰ~Ⅱ层),这是伤害性感觉信息的接收区域。单细胞RT-PCR结果显示,78%的shEGFP+神经元为兴奋性神经元(Vglut2+),22%的shEGFP+神经元为GABA能神经元(GAD65/67+)。这与之前的研究结果一致,即大多数对伤害性热刺激产生反应的神经元是兴奋性神经元。然而,shEGFP+神经元具有极高的异质性,涉及到多种类型的神经元,比如,其中胆囊收缩素阳性(Cholecystokinin+, CCK+)和生长激素抑制素阳性(Somatostatin+, SST+)神经元分别占18%和14%。值得注意的是,~1/3的shEGFP+神经元表达了ErbB4,而ErbB4主要表达于兴奋性神经元中。
这些结果表明,伤害性热刺激能够激活一群ErbB4+兴奋性神经元。为了验证这一假设,作者对ErbB4:: CreER;Ai9小鼠进行热刺激,该小鼠tdTomato的表达依赖于内源性的ErbB4启动子。在脊髓中,ErbB4-tdT+神经元主要集中在背角,分布于多层背角和脊髓外侧核(Lateral Spinal Nucleus, LSN)中,然而,热激活的ErbB4-tdT神经元(cFos+)主要位于脊髓背角表层中。ErbB4-tdT神经元约占cFos+神经元的33%。这些结果确认了脊髓背角表层ErbB4+兴奋性神经元是一种新型的伤害性热反应细胞。
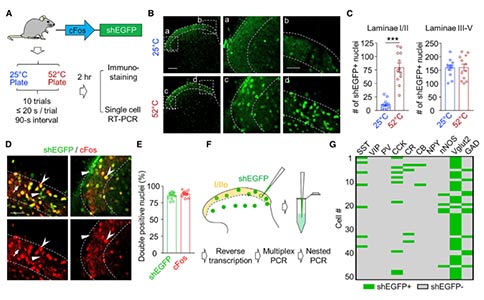
2. 脊髓ErbB4+,SST+和CCK+神经元负责伤害性热刺激感受
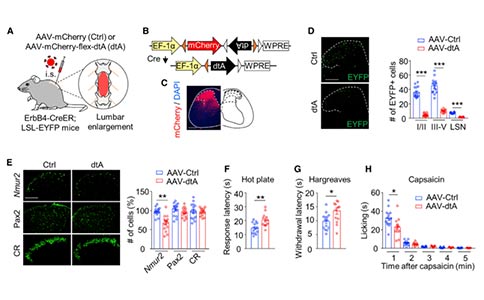
接下来,作者通过在ErbB4::CreER;LSL-EYFP(ErbB4-EYFP)小鼠椎管内注射AAV-mCherry-DIO-dtA(AAV-dtA)病毒,在ErbB4+细胞中特异性的表达A型白喉毒素(diphtheria toxin subunit A, dtA)来消融脊髓中的ErbB4+神经元。与注射对照病毒的小鼠相比,注射AAV-dtA的ErbB4-EYFP小鼠中EYFP+细胞和Nmur2+神经元数目显著减少。接下来,小鼠接受了一系列的行为测试。与对照小鼠相比,注射AAV-dtA的ErbB4-EYFP小鼠在热板以及哈格里夫斯实验中,后爪退缩和舔爪的潜伏期中增加了~40%,表明ErbB4+神经元对伤害性热刺激的感受至关重要。辣椒素能够激活感觉神经元中的TRPV1受体,诱发自发性疼痛,与对照组相比,在AAV-dtA注射的ErbB4-EYFP小鼠,辣椒素诱导的小鼠舔足次数减少了30%。这些结果表明,ErbB4+神经元是伤害性热刺激的感受所必需的。此外,注射AAV-dtA的ErbB4-EYFP小鼠对机械刺激、冰冷-温热、以及痒刺激的反应与对照类似。这表明脊髓ErbB4+神经元可能不参与这些刺激的感受。
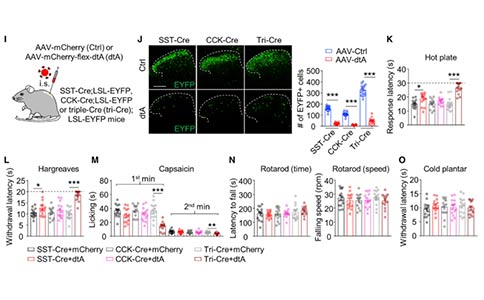
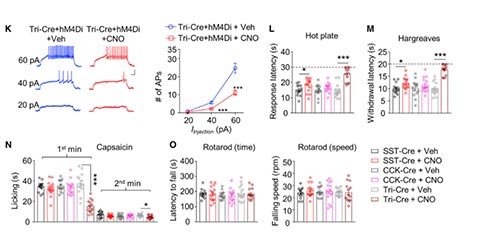
除了ErbB4+神经元,SST+和CCK+中间神经元也会被伤害性热刺激激活。为了确定它们对热刺激感受的贡献,作者分别消融了这些神经元。在热板以及哈格里夫斯实验中,消融SST+神经元后小鼠的反应潜伏期分别增加了26%和22%,而消融CCK+神经元的反应潜伏期则没有增加。值得注意的是,将ErbB4+、SST+和CCK+三类神经元同时消融时,小鼠对伤害性热刺激感受的抑制作用显著增加到60% - 80%。这些结果表明,伤害性热刺激感受涉及脊髓中的ErbB4+、SST+和CCK+神经元。
3. ErbB4+神经元受TRPV1+痛觉感受器的单突触神经支配,且能被伤害性热刺激而非机械刺激所激活
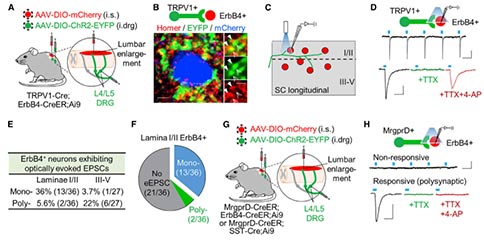
不同的躯体感觉信息由不同类型的传入纤维传入脊髓背角:Aβ纤维主要用于传递非伤害性刺激,而Aδ和C纤维用于传递伤害性刺激。为了确定ErbB4+神经元的信息来源,作者利用带背根的纵向脊髓切片来记录背角中ErbB4+神经元的兴奋性突触后电流(EPSCs)。对于Aδ和C纤维的刺激传入,分别有76%和54%的表层ErbB4+神经元记录到了EPSCs,其中67%和46%的ErbB4+神经元为单突触传入。相比之下,表层中有25%的ErbB4+神经元记录到Aβ纤维信息传入,只有9.1%是单突触传入。此外,在深层ErbB4+神经元中,6.7%和5.6%的神经元接受Aδ和C纤维的单突触传入。这些结果表明,浅表层的ErbB4+神经元主要接受携带伤害性信息的C和Aδ纤维的单突触传入。
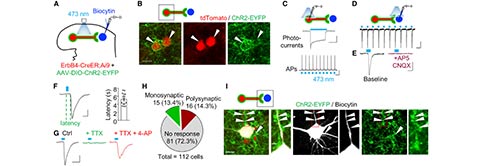
为了验证ErbB4+神经元是否被TRPV1+伤害性感受器的突触支配,作者用到了QX-314(一种细胞内钠通道抑制剂,其细胞进入依赖于TRPV1的激活)。单独使用QX-314对C纤维传入的ErbB4+神经元EPSC振幅影响不大。然而,在TRPV1激活物辣椒素存在的情况下,QX-314使EPSCs减弱,表明ErbB4+神经元接受TRPV1+纤维的支配。与之一致的是,在QX-314和辣椒素的存在下,对C纤维刺激有反应的ErbB4+神经元的数量减少了。这种作用是C纤维特异性的,因为A纤维中TRPV1表达较低,QX-314对刺激A纤维产生的EPSCs的影响不大。这些结果为表层ErbB4+神经元受TRPV1+ C纤维的支配提供了药理学依据。为了找到这种神经支配的形态学证据,作者将AAV-DIO-mCherry注射到TRPV1::Cre;ErbB4::CreER小鼠脊髓腰膨大区标记ErbB4+神经元,并将AAV-DIO-ChR2-EYFP注射到DRG中标记TRPV1+末端。脊髓切片用突触后标记物Homer进行染色标记。可以看到ErbB4+神经元(mCherry+)被TRPV1+末端(即EYFP+)包围。TRPV1+末端与Homer+突触以及ErbB4+细胞密切相关。这些结果进一步表明,脊髓背角表层ErbB4+神经元受到DRG中TRPV1+ 传入纤维的支配。
为了证明这些突触是有功能的,作者利用光遗传学激活表达视蛋白ChR2的TRPV1+末端。42%的表层ErbB4+神经元能够在光刺激下诱发EPSCs,这些EPSCs被TTX所抑制,而在TTX和4-AP同时存在的情况下,仍有36%的ErbB4+表层神经元能够被光刺激诱发EPSCs,这表明它们是由DRG中TRPV1+传入纤维的单突触所支配的。综上所述,脊髓背角表层ErbB4+神经元直接受TRPV1+伤害性感受器的单突触神经支配。
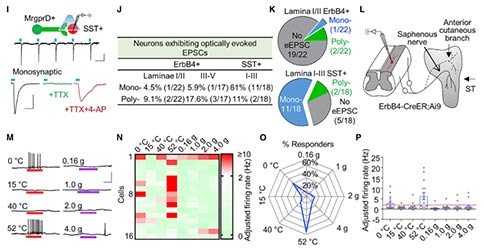
为了确定ErbB4+神经元是否对机械刺激产生反应,作者将AAV-DIO-ChR2-EYFP注射到MrgprD::CreER;ErbB4::CreER小鼠DRG中,让传导机械刺激的MrgprD+神经元表达ChR2,同时将AAV-DIO-mCherry注射到腰膨大来标记ErbB4+神经元。然而,对脊髓切片进行光刺激,大多数的ErbB4+神经元(87%)未能记录到EPSCs,这表明大多数ErbB4+神经元不接受来自机械刺激感觉神经元的传入。在3个响应ErbB4+神经元中,有2个被TTX和4-AP抑制,表明它们接受了多级突触传导,只有一个出现了4-AP增强的EPSCs,表明其受到机械感觉神经元的单突触支配。作为对照,作者采用了相同的策略来观察SST+脊髓神经元对机械感觉神经元刺激的反应。大多数记录的SST+神经元(72%)产生了光刺激诱导的EPSCs,表明它们接受MrgprD+机械感觉神经元的传入,且61%为单突触支配。这些结果表明,脊髓背角表层ErbB4+神经元主要受伤害性热刺激感受神经元的支配,而非机械刺激感觉神经元的支配。
为了进一步表征在更接近生理条件下ErbB4+神经元的敏感性,作者构建了半完整的离体检测范式,通过分离相连的部分脊髓、腰椎根、DRG、隐神经和后肢皮肤,来记录脊髓ErbB4+神经元对皮肤刺激的反应。在记录的16个ErbB4+神经元中,有9个(56%)对52℃刺激有反应,有5个(30%)对0℃刺激有反应。对15℃和40℃刺激有反应的神经元分别为1个(7%)和2个(13%)。这些结果表明,表层ErbB4+神经元对伤害性热刺激的反应较好,其次是冰冷刺激,而对凉或温热刺激的反应较弱。为了确定ErbB4+神经元是否对机械刺激有反应,研究者用Von-Frey丝刺激皮肤。在16个记录的神经元中,有14个无反应。这些结果表明,脊髓背角表层ErbB4+神经元对伤害性热刺激比机械刺激更敏感。
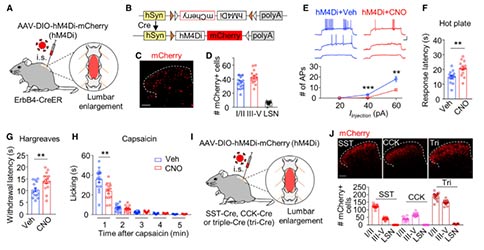
4.抑制ErbB4+神经元会减弱动物对伤害性热刺激的感受,反之则增强动物对热刺激的感受
随后,作者探讨了脊髓ErbB4+神经元活性对伤害性热刺激感受的影响。为了降低ErbB4+神经元的活性,作者将AAV-DIO-hM4Di-mCherry(AAV-hM4Di)注射到ErbB4::CreER小鼠的脊髓腰膨大,并通过CNO来抑制ErbB4+神经元活性。与对照相比,抑制ErbB4+神经元增加了小鼠在热板和哈格里夫斯实验中的反应潜伏期,并减少了辣椒素诱导的舔足。抑制SST+而非CCK+神经元,小鼠在热板以及哈格里夫斯实验中的反应潜伏期增加,但对辣椒素诱导的舔足没有影响。值得注意的是,当这三类的神经元活性同时降低时,小鼠对伤害性热刺激感受的抑制效果增加60%~80%。这些结果表明脊髓ErbB4+、SST+和CCK+神经元的活动共同参与伤害性热刺激感受,支持群体编码模式理论。
为了增加脊髓ErbB4+神经元的活性,作者将AAV-DIO-hM3Dq-mCherry注射到ErbB4::CreER小鼠的脊髓腰膨大。与对照相比,激活ErbB4+神经元降低了小鼠在热板和哈格里夫斯实验中的反应潜伏期,且增加了辣椒素诱导的持续舔足时间。表明, ErbB4+神经元激活增强了动物对伤害性热刺激的感受。总之,这些结果揭示了ErbB4+神经元在伤害性热刺激感受中的关键作用。
5. 伤害性热刺激的感受依赖ErbB4激酶的活性
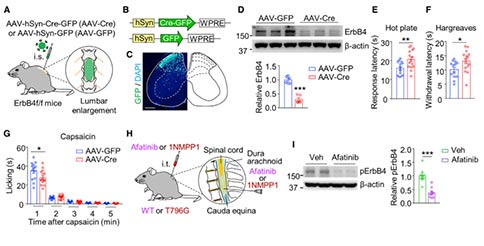
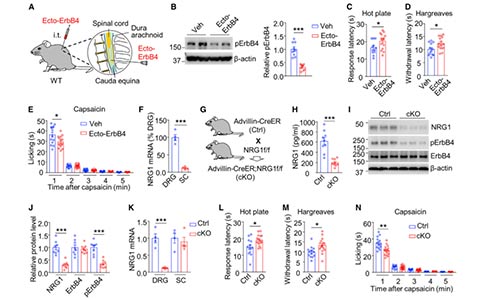
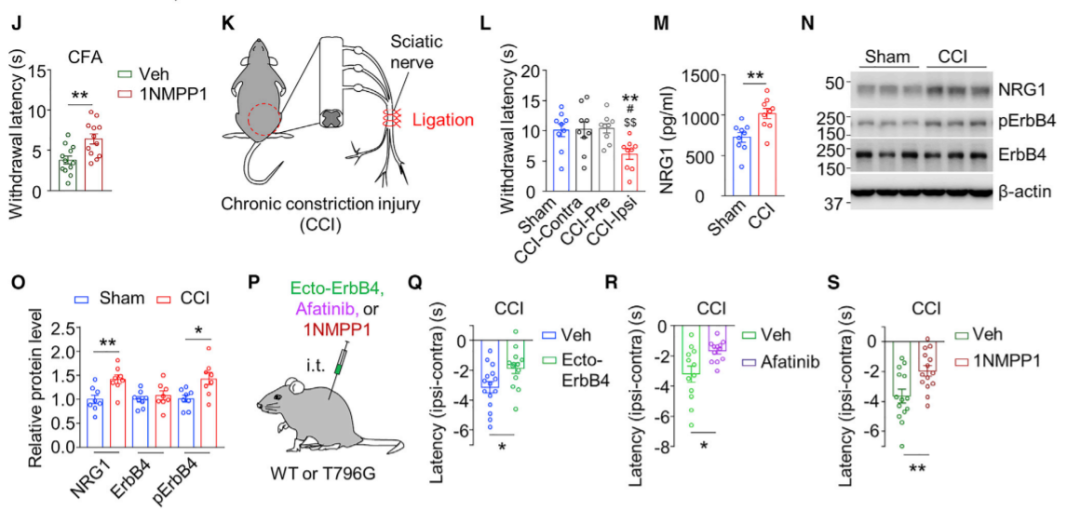
ErbB4由生长因子神经调节蛋白1(Neuregulin 1, NRG1)所激活,为了检测NRG1-ErbB4信号通路是否参与了伤害性热感受,作者检测了脊髓背角NRG1和pErbB4的表达。结果显示,暴露于52℃热板的小鼠其脊髓背角NRG1和pErbB4的表达增加,表明伤害性热刺激可以增强脊髓背角的NRG1-ErbB4信号。接下来,作者评估了 ErbB4的存在对伤害性热刺激的感受是否必要,为此,作者构建了ErbB4-rKO小鼠(该小鼠在除心脏外的任何组织,包括脊髓中都不表达ErbB4)。值得注意的是,与对照组小鼠相比,ErbB4-rKO小鼠在热板和哈格里夫斯实验中的反应潜伏期增加,且辣椒素诱导的舔足次数减少,表明ErbB4在这些反应中发挥了作用。随后,为了消除其它组织中ErbB4突变可能存在的影响,作者通过在ErbB4f/f小鼠脊髓腰膨大注射了AAV-Cre-GFP病毒,来特异性的敲除脊髓背角中的ErbB4。与对照组相比,脊髓背角ErbB4敲除使得小鼠在热板和哈格里夫斯实验中的反应潜伏期增加,辣椒素诱导的舔足次数减少。这些结果揭示了ErbB4在伤害性热刺激感受中的必要作用。
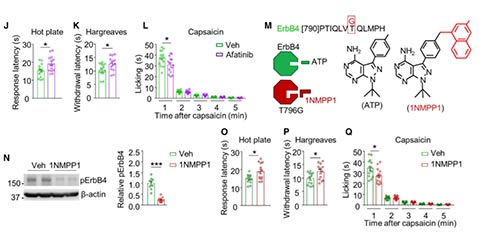
为了确定热感受是否涉及ErbB4的激酶活性激活,作者以鞘内注射的方式给小鼠注射阿法替尼(一种ErbB激酶抑制剂)。阿法替尼显著减少了脊髓腰膨大中pErbB4的表达。动物在热板、哈格里夫斯和辣椒素实验中的反应也减弱,但对针刺、掐和Von-Frey丝刺激反应的影响不大。这些结果提示ErbB4激酶活性与伤害性热刺激感受有关。为了进一步验证这一点,作者对敲入突变株的T796G小鼠进行了研究,在T796G小鼠中,ErbB4可以被体积较大的抑制剂1NMPP1特异性抑制。鞘内注射1NMPP1可降低脊髓腰膨大中pErbB4的表达。在行为反应测试中,1NMPP1显示了类似阿法替尼的效果。总之,这些结果表明脊髓中ErbB4的激酶活性与伤害性热刺激感受有关。
6. DRG中的NRG1参与了伤害性热刺激的感受
为了确定伤害性热刺激感受是否与内源性NRG1有关,小鼠被注射了ecto-ErbB4(一种NRG1中和肽)。鞘内注射ecto-ErbB4可减少脊髓中的pErbB4表达,并且增加小鼠在热板和哈格里夫斯实验中的反应潜伏期,减少辣椒素引起的舔足,但不会影响对针刺、掐和Von-Frey刺激的反应。这些结果表明,内源性NRG1参与了伤害性热刺激的感受。
NRG1在DRG中大量表达,为了确定DRG神经元中的NRG1是否参与热感觉,作者构建了advillin-CreER;NRG1f/f小鼠,通过给予他莫西芬,可以诱导小鼠感觉性神经节中NRG1的条件性敲除(cKO)。与对照相比,cKO小鼠脊髓中的NRG1和pErbB4蛋白的表达均减少,NRG1 mRNA的水平在DRG中降低,但在脊髓中没有显著变化。cKO小鼠在热板和哈格里夫斯实验中的反应潜伏期增加,在辣椒素实验中的舔足次数减少。然而,脊髓中的NRG1敲低对热刺激行为反应或背角中的pErbB4几乎没有影响。这些结果表明DRG中的NRG1信号在伤害性热刺激的感受中起作用。
7. NRG1-ErbB4信号能够调控ErbB4+神经元谷氨酸的传递
上述结果已经证明,表层中c-Fos+ ErbB4+神经元大部分是兴奋性神经元。为了确定NRG1和ErbB4是否能够调节谷氨酸的传递,作者将AAV-DIO-ChR2-EYFP病毒注射到ErbB4::CreER;Ai9小鼠中,在ErbB4+神经元中特异性表达ChR2。在脊髓切片中,通过光刺激激活这些表达ChR2的ErbB4+神经元,并在其邻近的ErbB4-神经元中记录突触后电流(PSCs)。在记录的112 个ErbB4-神经元中,当膜电位钳制在-70 mV时,其中31个神经元记录到了光刺激诱发的内向电流;当膜电位为0 mV时,所有神经元均未记录到光刺激诱发的外向电流,表明这些电流是EPSCs,而不是IPSCs。这些结果表明,表层的ErbB4+神经元通过谷氨酸传递与下游神经元进行交流。事实上,这些EPSCs能够被AMPA受体和NMDA受体抑制剂CNQX和AP-5阻断。根据这些EPSCs对TTX和4-AP的潜伏期和阻抗,可以确定,半数下游神经元接受ErbB4+神经元的单突触神经支配。用生物素标记这些记录神经元的形态特征也支持这一观点。
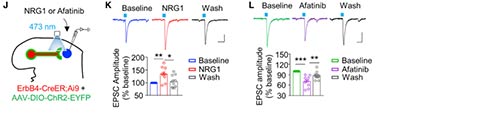
接下来,作者确定了ErbB4+神经元和靶细胞之间的谷氨酸传递是否受到NRG1-ErbB4信号通路的调控。在给予NRG1后的15分钟内,光刺激诱发的EPSCs的波幅显著增加,而这种作用在洗脱后减弱,表明NRG1促进谷氨酸传递。此外,给予ErbB4抑制剂阿法替尼降低了EPSC幅值,表明ErbB4激酶活性的参与谷氨酸传递。总之,这些数据证明了NRG1-ErbB4信号通路在脊髓谷氨酸传递中的作用。
8. NRG1-ErbB4信号通路参与病理性的热痛过敏
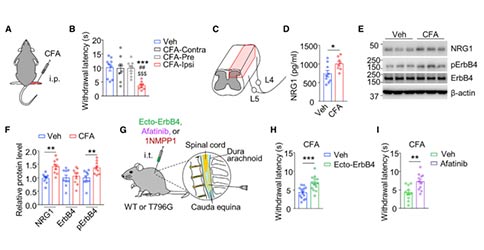
在周围神经炎症或损伤等病理条件下,机体对热刺激的反应更加敏感。在完全弗氏佐剂(Complete Freund’s Adjuvant, CFA)引起炎症性疼痛模型中,小鼠患肢在哈格里夫斯实验中的反应潜伏期显著降低。以下证据能够表明NRG1-ErbB4信号通路在炎症引起的热痛过敏中起作用。首先,NRG1和pErbB4在CFA注射小鼠的同侧脊髓腰膨大中的表达增加。第二,在哈格里夫斯实验中,鞘内中和NRG1能够增加小鼠撤足的潜伏期。第三,阿法替尼能够抑制野生型小鼠的热痛过敏,1NMPP1能够抑制T796G小鼠的热痛过敏。
此外,作者还研究了该通路在慢性压迫性损伤(Chronic Constriction Injury, CCI)诱导的热痛过敏反应中的潜在作用。CCI能够诱导小鼠在哈格里夫斯实验中的反应潜伏期降低,提示发生热痛过敏。与假手术小鼠相比,CCI组小鼠同侧腰膨大中NRG1和pErbB4的表达升高。野生型鞘内给予ecto-ErbB4、阿法替尼、或T796G小鼠给予1NMPP1均可降低CCI引起的热痛过敏。这些结果支持NRG1-ErbB4信号通路参与病理性的热过敏的观点。
总结
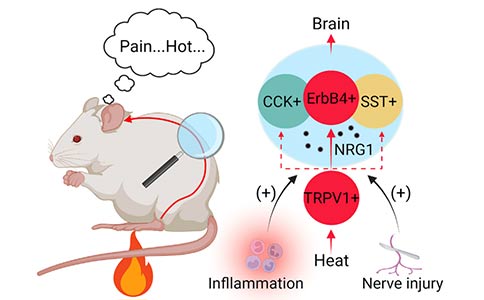
该研究通过分析热刺激感受神经元,识别出脊髓背角表层ErbB4在伤害性热刺激的感受中发挥了关键作用。这些ErbB4+神经元显示以下特性。首先,它们主要接收来自携带伤害性信息的Aδ和C纤维的单突触传入,而不是接受来自携带非伤害性信息的Aβ纤维传入。其次,ErbB4+神经元受DRG中TRPV1+伤害性传入纤维的单突触支配,对伤害性热刺激反应较好,而对机械刺激反应较差。第三,消融或抑制ErbB4+神经元减弱了动物在热板、哈格里夫斯以及辣椒素实验中的反应,表明它们的活动与伤害性热刺激的感受有关。最后,文章证明了NRG1-ErbB4信号通路在生理条件下的伤害性热刺激感受和病理条件下的热痛过敏反应中的作用。
亮点研究方法