大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型的制作已经成熟,但对活体成功模型的评判标准尚欠客观,目前国内对活体大鼠模型成功与否的评价仍无明确客观的标准,多以大鼠麻醉清醒后出现插栓对侧前肢不能前伸、运动旋转追尾等表现评价,具有一定的主观性。能否利用客观可行的方法提高对模型成功与否评价的客观性?
石墨烯具备了许多神经电极活性材料的特性,如良好的相容性、化学稳定性、柔韧性、光学透明性和高导电性等,为更精准的神经电生理研究提供了新的选择。
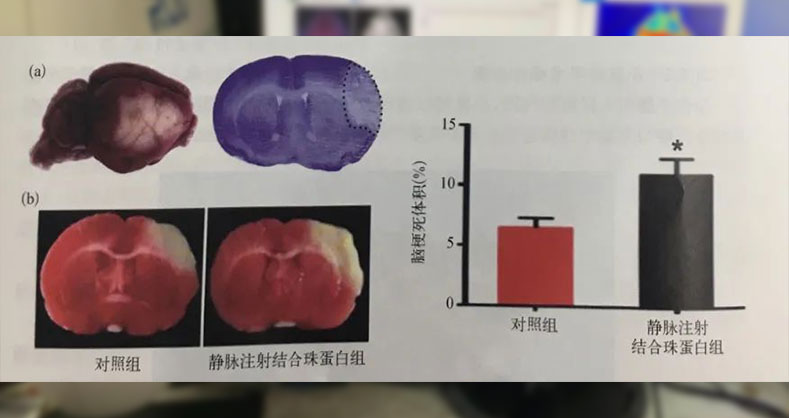
目前缺血性脑卒中的治疗方法仅限于快速溶栓或血管内血栓清除以恢复脑血流灌注,但是脑梗死后的血流恢复可能会引起氧化应激和炎症反应,造成再灌注损伤,加剧大脑损害。
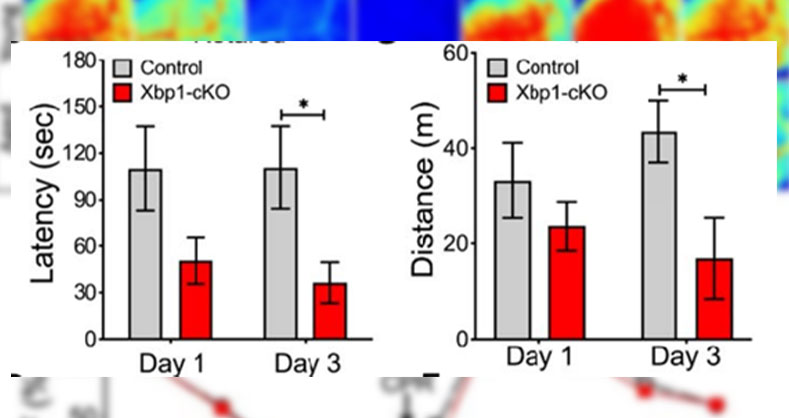
心脏骤停和复苏导致脑缺血再灌注(I/R)损伤,与脑神经元的死亡密切相关。为此,研究者们通过促进受损的细胞功能的恢复,试图维持细胞内稳态,以此来开拓一种内源性的治疗方法。实验结论:激活的XBP1可以对CA后的脑神经起到保护的作用。
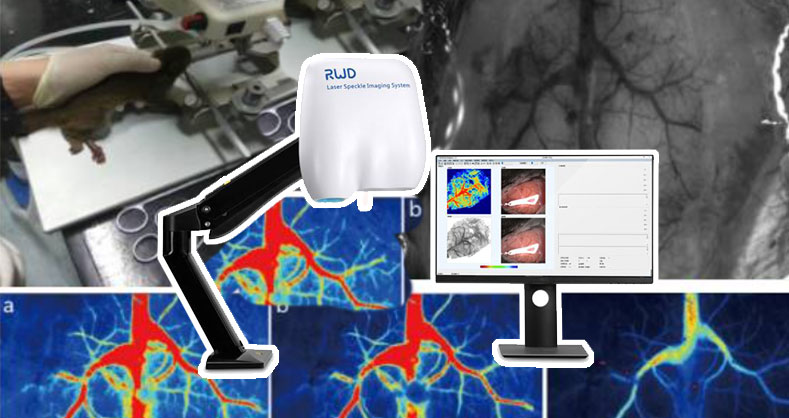
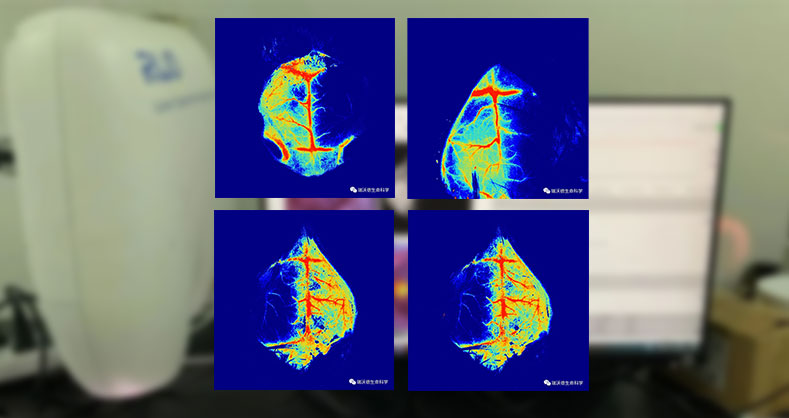
RFLSI ZW激光散斑血流成像系统基于LSCI(laser speckle contrast imaging)技术设计,具有非侵入性、高帧率、高分辨率的优势,用于实时监测和记录暴露组织器官的血流灌注情况。精准量化微循环血流量,满足广泛的科研场景。
微纳米机器人从内部或外部环境获取能量,从而实现主动运动。由于它们体积小,运动可控等特性使其能够广泛地应用于生物医学领域,尤其是血管内系统,如血栓清除、伤口愈合和药物输送。
建立具有简便、可靠、重复性好、稳定性高的大脑中动脉远端阻塞模型,有利于脑缺血病理生理学的研究,也可以利用该模型对各种预防、治疗脑缺血的方法和药物进行评价。本次介绍的大脑中动脉远端阻塞模型是利用双极电凝或者手术缝线将大鼠(或小鼠)的大脑中动脉主干进行电灼或结扎以阻断其供血。该模型具有脑梗面积及部位重复性好、物存活率高、梗死体积相对较小等优点,能较好地模拟临床卒中特点。
传统的微循环研究方法主要有“管腔分布走行及超微形态学观察”、“通透性评估”、“血管运动及调节”、“细胞培养法”等, 这些检测方式多为“离体静态检测”和“离体动态检测”。但是,目前离体检测存在一些缺点:离体状态的生理环境和各项指标会与活体状态有较大差距。样本通常需要处死并解剖,无法完成良好的自身对照控制个体间的差异。操作较为繁琐,降低实验效率。
脑缺血性血管病(I CVD)约占全部脑血管病的80%。具有高发病率、高致残率、高死亡率的特点,是严重危害人类健康的疾病之一。由于临床研究的种种限制,脑缺血动物模型已成为研究脑血管病损伤机制和防治措施不可缺少的工具。因此,建立最接近人类脑缺血的理想动物模型,具有重要意义。
类淋巴系统紊乱可能导致致病蛋白在大脑中的累积,这与多种脑部损伤和神经退行性疾病的发病机制密切相关。