线虫显微注射的超详细实验步骤!
秀丽线虫(Caenorhabditis elegans)是研究动物遗传、个体发育和行为活动的重要模式生物,能够研究从分子细胞水平到整体系统水平的相关生命活动的作用机理。显微注射技术使用尖端开口直径为微米级的玻璃微管,将核酸注入线虫的性腺,进而被成熟的卵细胞吸收,以染色体外遗传物质的形式存在。而显微注射技术是线虫领域的核心技术,广泛应用于研究线虫的基因表达、功能和基因间的相互作用等。
(图片来源于摄影师马克奥-西奥卡)
实验仪器及试剂
主要仪器包括:
显微操纵器、拉制仪、注射泵、体式显微镜或倒置显微镜等。
试剂耗材包括:
琼脂糖、矿物油、带芯玻璃管、载玻片、拾取针、恢复缓冲液、OP50培养基、加样针等。
实验步骤
01 制备琼脂糖固定板
移液枪取约50μl加热溶解的2%琼脂糖溶液滴在24mm×60 mm的载玻片上,用另一载玻片轻压其上(小心气泡产生),待琼脂糖凝固后(约5分钟),将上面的玻片从侧面滑下即可。将制作好的琼脂板室温过夜或80℃干燥1小时后可叠放起来备用。

图:琼脂糖固定板的制备[1]。A. 用两条胶带将载玻片固定在干净的工作台上;B. 在载玻片中间滴一滴约50μl新鲜热熔2% 琼脂糖溶液;C. 将显微镜载玻片放在琼脂糖滴上,轻轻按下使其变平。琼脂糖凝固并取出显微镜载玻片。
02 制备注射针
注射针对于注射成功与否至关重要,使用水平拉制仪通过调节速度、拉力等参数可稳定获得两根相同的注射针,建议使用有芯玻璃管进行拉制,其芯能够使注射液迅速充满针头尖端,可以很好的排出气泡。注射针的锥度一般5-7mm,尖端0.5-0.9μm。
MP-500有着前卫智能的操作界面及加热片限位槽等人性化设计,集安全性与人性化于一体,轻松满足微电极相关实验的需求。

(瑞沃德MP-500微电极拉制仪)
03 制备注射液并加入注射针
根据实验需求,选择拟注射的物质,包括DNA、RNA、蛋白质等。注射物的纯度是转入效率高低的重要影响因素之一。通过注射针的尾端,用细长的加样针将注射液灌入,等待数分钟,观察针尖有无气泡。
04 注射体积校准
将注射针装到注射泵上,吸入待注射液。在显微镜视野中心放一把微尺,上面放置一个装适量矿物油的4厘米的培养皿。将注射针浸入矿物油中,注射一次得到一个液滴球,通过微尺测量球体直径计算出注射的体积,调整注射液滴的大小使其符合所需的直径。1 nL液滴的半径为0.062 mm (V = 4/3πR3)。
瑞沃德R480玻璃微电极注射泵,注射精度高,运行稳定,密封性良好,保证注射过程不会出现漏液情况。

(R480玻璃微电极注射泵)
05 破针
将玻片放在加入注射油的琼脂垫上,移动微操使注射针与玻片边缘相撞,注射针尖端被撞破,可观察到有液泡自动渗出,该方法更易于刺入线虫体内。
06 固定线虫
一般挑选即将产卵或体内有少量卵的年轻成虫进行注射,此时期性腺发育成熟,较易被DNA 转染从而产生转基因后代。使用拾取针将线虫挑至琼脂糖固定垫上,调整位置使性腺暴露,滴加注射油覆盖整个虫体。固定操作要迅速,否则线虫容易脱水而死。
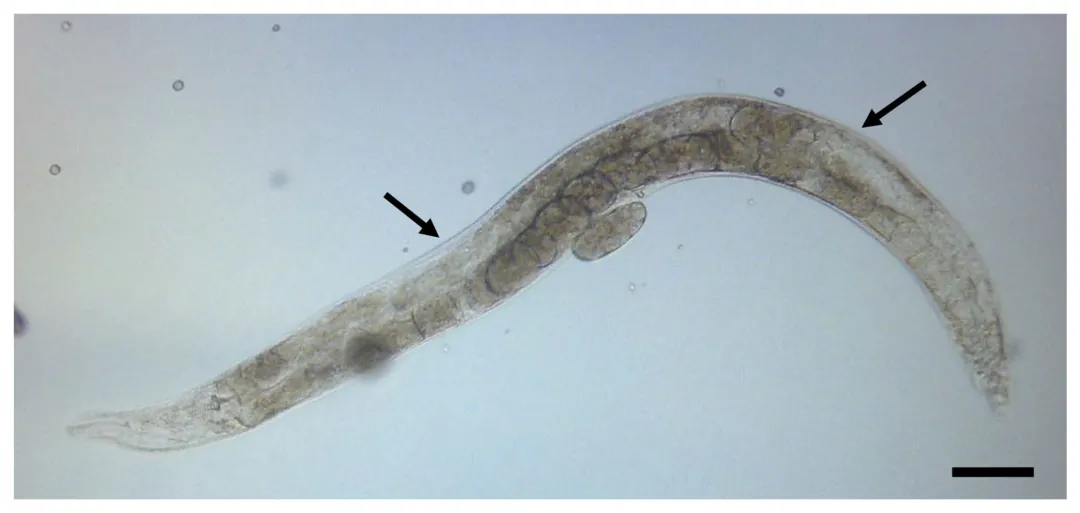
图:固定在固定板上并准备注射的线虫。箭头表示在性腺中注射首选部位。比例尺为50μm[1]。
07 注射
将琼脂糖固定板放在载物台上,显微镜下找到线虫,调整焦距,将性腺部位聚焦在正确的平面。使用微操,将注射针尖刺入性腺。启动微量注射泵进行注射,能观察到注射液在性腺中快速流动,注射后的性腺被液体充满。
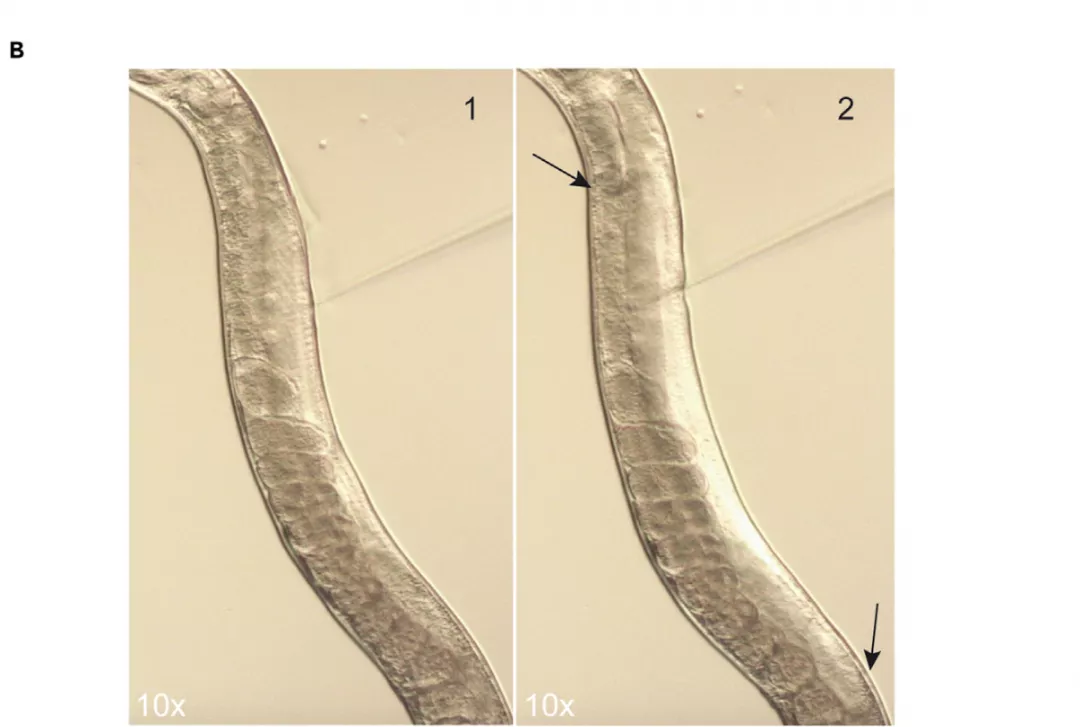
图:显示注射物注射前(1)和注射后(2)的流动。箭头标记性腺中的区域,注射物到达的位置[2]。
MM-500电动显微操纵器与显微镜配合使用,可以完成人手不能从事的精细运动的显微操作,体积小巧轻便,人性化中英文操作界面,操作起来更便捷。

(点击图片,了解更多)
08 恢复
在体视显微镜下,滴加恢复缓冲液至注射后的线虫。一般等待2-5 min,线虫活力恢复,即头部左右摇摆,身体开始游动,即可挑至培养板上,进行20℃常规培养。
瑞沃德提供MP-500程控水平电极拉制仪、MM-500电动显微操纵器、R480玻璃微电极注射泵组合方案,可对斑马鱼、线虫等胚胎、幼体进行超精细显微注射。
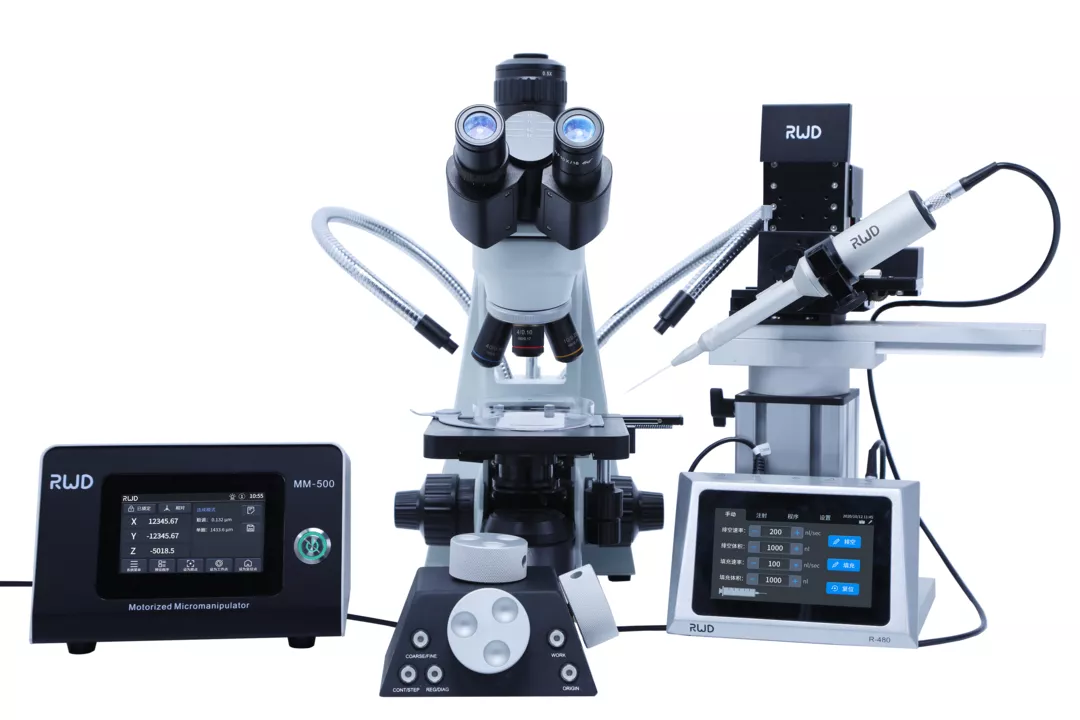
瑞沃德注射系统
注意事项[2]:
a.琼脂糖固定板:若线虫在琼脂糖固定板上短时间内死亡,则说明固定板过于干燥,可换琼脂糖层稍薄的固定垫,因为琼脂糖的主要作用是吸收线虫的水分;若线虫无法粘牢,则说明固定垫太湿或太薄,可继续在烘箱内放一段时间,或将线虫先粘在固定垫上后加油;
b.注射物质:注射DNA使用前要混匀并离心以避免杂质阻塞针头。注射DNA的总浓度一般控制在200mg/L以下,因为较高浓度的DNA可能产生毒性或过量表达,从而影响下一代的表型恢复;
c.注射角度:注射针与性腺最好呈锐角,推荐与头部或尾部几乎平行或呈15℃角;
d.实验样本:被注射的线虫需要保证其食物充足,生长状态健康;
f.注射后线虫死亡率高:注射后等待恢复的时间过短或太长;可能是注射针尖太粗或注射DNA 被污染。针对此原因,可使用较细注射针,每次只注射一侧性腺,若注射操作正确,但不产生转基因线虫,则可能是转基因致死或注射核酸污染,可重新纯化。