二血管阻塞慢性脑缺血模型的制作
二血管阻塞慢性脑缺血模型
本文介绍模拟慢性脑血流低灌注所致病理生理改变及认知障碍的啮齿类动物模型,包括大鼠双侧颈总动脉结扎和小鼠双侧颈总动脉狭窄模型。其中,大鼠双侧颈总动脉结扎模型通过结扎大鼠双侧颈总动脉实现,小鼠双侧颈总动脉狭窄通过在小鼠的双侧颈总动脉植入钢制线圈实现。结扎大鼠双侧颈总动脉造成脑血流的下降并能较好模拟慢性缺血所致的病理改变,操作简单、重复性好、死亡率低,被广泛用于慢性脑缺血的研究。该模型可造成脱髓鞘改变、轴突丢失、胶质细胞增生等白质损伤的病理改变。
此外,将结扎大鼠双侧颈总动脉与降低平均动脉压(降至50mmHg)结合,并在缺血10~30min后重新恢复血供,可用于模拟前脑缺血。该模型可引起脑内易感脑区神经元的选择性、延迟性死亡,包括新皮质、海马CA1区的锥体神经元以及尾侧壳核。其中,海马神经元损伤与记忆受损及认知障碍密切相关。该模型所致的神经元选择性损伤可通过组织学和行为学检测方法进行评估。二血管结扎模型手术步骤简单、再灌注操作容易,故较四血管结扎模型更具优势。

MSI DigiGait动物步态成像分析系统
可完整定量评估鼠类模型中动物脚步和步态
动物选择
大鼠
在建立大鼠二血管结扎的动物模型时,必须考虑动物的品系、性别以及年龄。由于雌激素对缺血结果有影响,通常选用雄性大鼠。在二血管结扎的动物模型中,最常用的动物是250~300g的雄性 Wistar大鼠。Sprague-Dawley(SD)大鼠和其他品系的大鼠亦可用于本模型的制作。
小鼠
常采用雄性C57BI/6小鼠,体重为24-30g。此外,沙鼠是较为常用的品系。由于转基因和基因敲除小鼠大多来源于C57BI/6品系,为了研究基因在慢性脑缺血病理生理机制中发挥的作用,故目前多用C57BI/6小鼠制作该动物模型。
制作步骤
1.大鼠手术操作步骤
所有操作均在无菌条件下进行。手术人员应戴口罩和无菌手套,穿无菌隔离衣。术前所有手术器械均应灭菌且在手术过程中存放在无菌溶液中,如恶霉灵溶液。

大鼠二血管结扎模型操作步骤
(a)大鼠头颈部血管及结扎部位示意图;(b)动物呈仰卧位;(c)颈部正中切口,暴露气管和双侧颈总动脉,用眼科镊分离并挑起颈总动脉;(d)暴露一侧颈总动脉,将一根外科丝缝线结扎颈总动脉用同样的方法分离并结扎另一侧颈总动脉
(1)将大鼠放入麻醉箱中,用含2%异氟醚的70%氧化亚氮和30%氧气的混合气体以5L/min的氧气流速进行麻醉诱导,3~5min后,大鼠进入麻醉状态,之后以1L/min的氧气流速进行维持。
(2)术前褪毛,聚维酮碘常规消毒手术区域。
(3)为了控制平均动脉压、动脉血气量和血糖含量,应同时行尾动脉插管。把2根电极通过小的皮肤切口插入双侧颞肌,以获取脑电图。在整个实验中,平均动脉血压和脑电图的获取依赖动力实验系统。
(4)通过尾动脉抽取动脉血,运用动脉血气体分析仪和血浆葡萄糖测定仪,对血气和血糖含量进行测定。
(5)在缺血前15min和缺血后15min对动脉血气和血糖含量进行测定,在整个实验过程中血液气体含量都保持在正常的生理范围内。
(6)在大鼠腹侧颈部皮肤正中线处做一个切口,小心分离两侧的颈总动脉和周围组织以及迷走神经。
(7)把直肠温度探测器插入到直肠中监测体温。热电耦33G温度探测器植入颞肌,监测头部温度。在动物身体和头部上方的热光源的帮助下,身体和头部温度在整个手术过程中保持在(37±0.2)℃。
(8)当所有的准备工作已经完成时,异氟醚的浓度保持在1%。
(9)在缺血前15min,监测血压中的气体含量,平均动脉血压、脑电图、直肠和头部温度,并且保持在正常的生理范围内。
(10)将两侧颈总动脉通过外科丝缝线5-0结扎以诱导脑血流低灌注。
(11)缝合皮肤,结束麻醉过程。大鼠仍然需要进行70%氧化亚氮和30%氧气的混合气体辅助呼吸,并且保持颞肌和直肠的温度在37℃,直到它从麻醉状态清醒过来,此过程通常需要30~60min。移除头部和直肠温度探测器后,把大鼠放回到其原来的笼子。
(12)密切监控大鼠呼吸,直到呼吸恢复平稳。1~2h后,大鼠可以转移至动物房,常规供应食物和水。
(13)颈总动脉闭塞分步法:为避免脑血流量突然出现相对严重的下降,可按以下步骤逐步闭塞颈总动脉。大鼠用异氟醚麻醉,颈腹正中切口。暴露左侧颈总动脉,与迷走神经轻轻分离,用三条结扎线(2-0)闭塞。1周后,做一个新的切口,右颈动脉同样被阻塞。
2.小鼠手术操作步骤
由于小鼠不能结扎双侧颈总动脉,在小鼠腹侧颈部皮肤正中线处作一个切口,手术显微镜下小心分离两侧的颈总动脉和周围组织以及迷走神经。用内径0.18~0.22mm、长度2.5mm的特制钢制微线圈分别缠绕在双侧颈总动脉分叉部的近心端以诱导脑血流低灌注。缝合皮肤,结束麻醉过程。小鼠仍然需要进行70%/30%的氧化亚氮/氧气辅助呼吸,并且保持颞肌和直肠温度在37℃,直到它从麻醉状态清醒过来,此过程通常需要30~60min。密切监控小鼠呼吸,直到呼吸恢复平稳。30~60min后,小鼠可以放回笼中,常规供应食物和水。因小鼠的Wlls环后交通动脉常缺如,同时结扎双侧颈总动脉,因椎基底动脉系统血流不能代偿颈动脉系统脑血流的剧烈下降,至脑组织缺血缺氧,极易造成动物的迅速死亡。
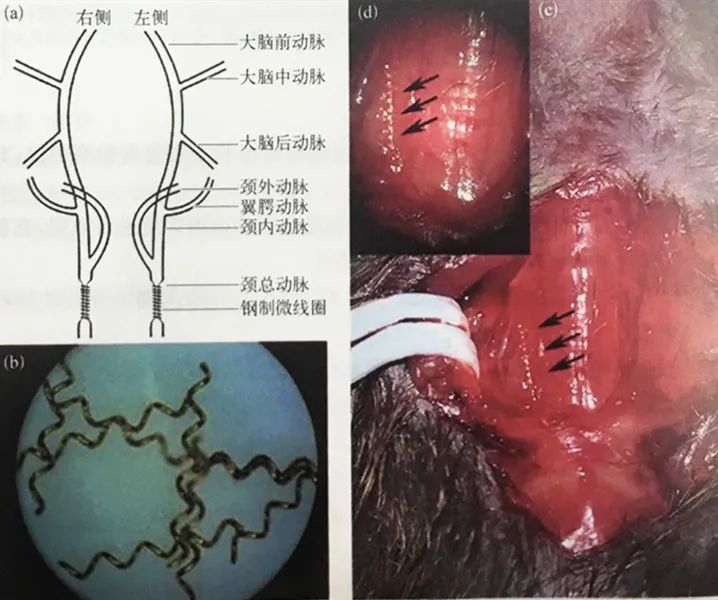
小鼠二血管狭窄模型操作步骤
(a)小鼠头颈部血管及钢制微线圈置入部位示意图;(b)钢制微线圈实物图;(c)颈部正中切口暴露气管和右侧颈总动脉,用眼科镊分离并挑起右侧颈总动脉将钢制微线圈缠绕在颈总动脉分叉部的近心端;(d)显微镜下(c)图的放大图,箭头所指即钢制微线圈
注意事项及常见问题解答
1.注意事项
以下要点对于二血管结扎的慢性脑缺血模型组织损伤的重复性非常重要:
- 在手术过程中,直肠和大脑的温度必须控制在(37±0.2)℃。大脑的温度尤其重要,因为没有血供会引起大脑温度的下降;而大脑温度的微小变化对于缺血引起的组织学损伤会产生显著的影响。
- 手术前夜对小鼠禁食以维持血糖水平的稳定同样非常重要。卒中前高水平血糖通常会引起更加严重的神经元损伤。
2.常见问题及解决方法
死亡大部分是由于术后并发症所导致。颈总动脉和迷走神经分离不清,误伤迷走神经导致动物呼吸困难。手术时间过长和手术过程中的不仔细同样会引起功能修复困难。此外,过度麻醉会引起动物在手术时死亡。因此,熟练操作,仔细分离颈总动脉是提高生存率的重要因素。
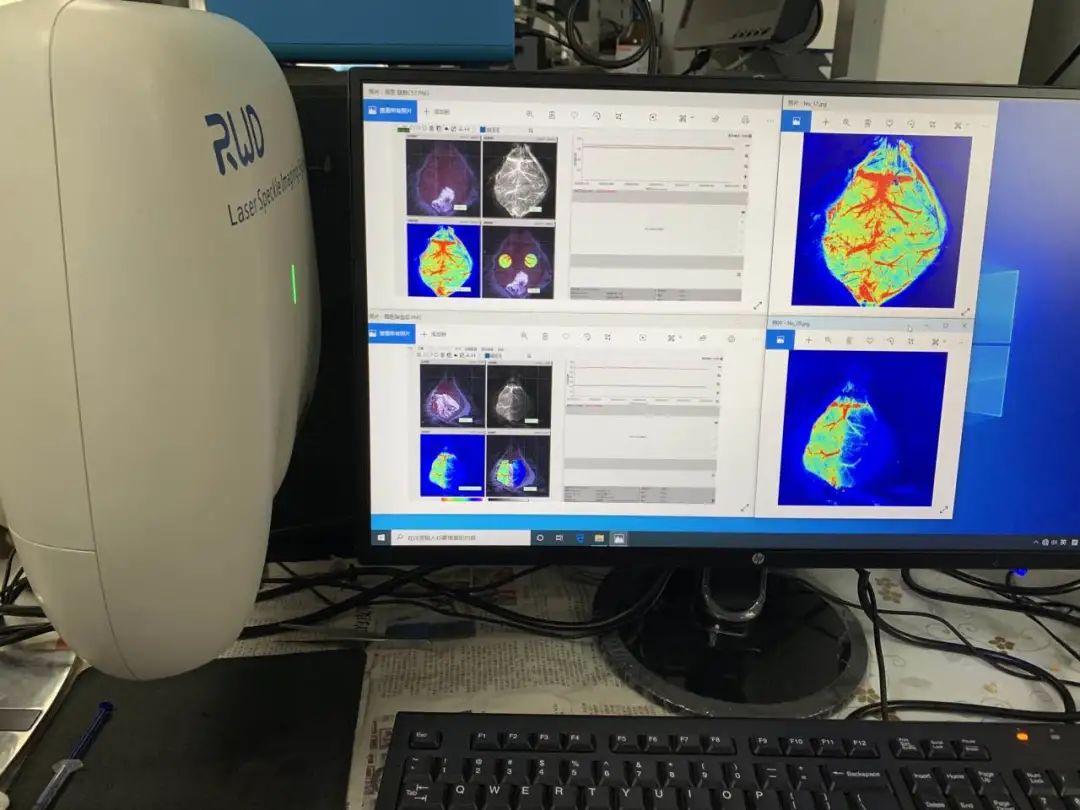
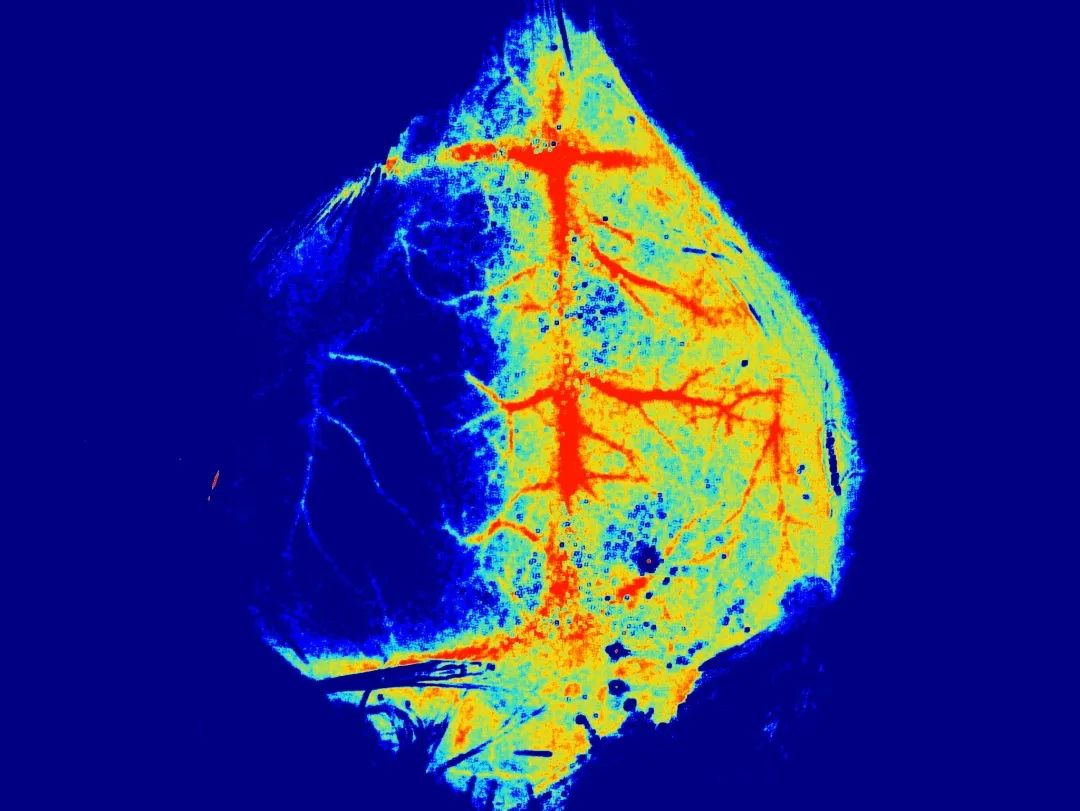
瑞沃德激光散斑血流成像系统可监测
大脑血流情况,准确判断造模是否成功
*以上内容部分源自《实验卒中模型方法学》
书号:ISBN 978-7-313-21776-9













