Caᵥ1.2合作门控如何被调节?UC Davis学者揭示糖尿病血管反应性变化新机制
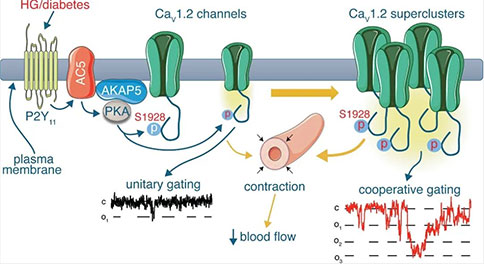
2022年12月2日,UC Davis分校的Manuel F. Navedo 和Madeline Nieves-Cintrón团队在Circulation Research杂志上发表题为“Spatiotemporal Control of Vascular CaV1.2 by α1C S1928 Phosphorylation”的研究论文。该研究证实,PKA依赖的pS1928(CaV1.2 α1C亚基S1928位点磷酸化)作为一个关键起始步骤,促进了糖尿病高血糖期间血管α1C亚基的空间重组,形成“超簇”,从而增加CaV1.2的活性和合作门控,直接影响血管反应性。因此,作者提出α1C亚基的pS1928是血管CaV1.2功能和血管反应性的变阻器,也是糖尿病高血糖期间血管并发症的危险因素。这一结果可能为开发纠正糖尿病高血糖时期CaV1.2和动脉功能的治疗方法奠定了基础。

在该研究中,作者首先利用膜片钳技术检测了2型糖尿病患者动脉肌细胞的CaV1.2通道特性,结果显示,糖尿病患者动脉肌细胞内CaV1.2通道的活性和协同性增强。CaV1.2协同性增加意味着α1C亚基必须在物理上接近,为此作者利用超分辨率纳米显微镜对α1C亚基的空间排布进行了观察,结果观察到糖尿病人动脉肌细胞中质膜α1C亚基重组成更大的簇,这可能是CaV1.2通道活性和协同性增强的基础。考虑到已有研究认为糖尿病高血糖引起的血管CaV1.2通道活性增加依赖于pS1928,作者进一步探讨了pS1928在高糖诱导的动脉肌细胞CaV1.2合作门控中的作用。利用野生型或者S1928A小鼠(1928丝氨酸位点突变为丙氨酸以防止其磷酸化)的动脉肌细胞,作者证实:高糖刺激引起的CaV1.2合作门控需要PKA依赖的pS1928,此外,高糖刺激能够诱导P2Y11/PKA依赖的pS1928,并导致α1C亚基的寡聚化/聚集增加。这些数据支持以下假设:高糖刺激诱导的pS1928能够促进动脉肌细胞α1C亚基空间重排成更大的簇,从而使动脉肌细胞CaV1.2的协同作用增强。
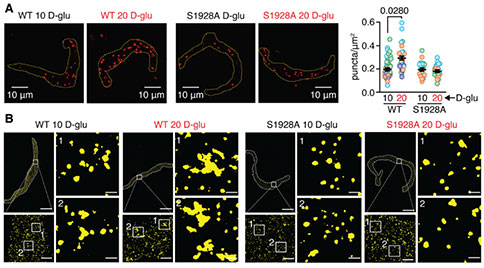
随后,作者进一步探讨了高糖环境下ps1928介导α1C聚集和CaV1.2协同性增加的生理效应。利用钙离子指示剂,作者观察到pS1928是高糖诱导的胞内Ca2+增加所必需的,并导致了动脉肌细胞的收缩。为了证实高糖环境下pS1928在体内的生理作用,作者利用激光散斑成像技术测量了麻醉小鼠的脑动脉肌源性张力和血流量(作者采用了RWD激光散斑血流成像系统)。在野生型小鼠中,用20 mmol/L D -葡萄糖向颅窗灌注导致动脉直径减小,进而转化为肌源性张力增加和血流量减少,而S1928A小鼠未见此情况。这些结果表明,高糖诱导的脑动脉肌源性张力和血流的改变需要依赖pS1928。考虑到高血糖与糖尿病的联系,作者利用链脲佐菌素诱导的1型糖尿病小鼠模型进一步验证了动脉肌细胞CaV1.2的结构和功能重塑是否需要pS1928。结果表明,糖尿病高血糖促进了ps1928依赖的动脉肌细胞内α1C的聚集,以及CaV1.2通道活性和协同性的增加。利用激光散斑血流成像技术,作者观察到,STZ诱导的野生型糖尿病小鼠脑血管的肌源性张力增加,血流量减少,而STZ诱导的S1928A小鼠脑血管的肌源性张力和血流量则与对照组无明显差异。这些结果表明,糖尿病高血糖诱导小鼠血管收缩张力和血流量的改变需要依赖pS1928。