新冠疫苗研发重要突破!中科院昆明动物研究所郑永唐团队开发出新型高效广谱的HR121新冠疫苗
新冠病毒(SARS-CoV-2)在全球范围内大流行已长达3年,其流行趋势仍未衰减。全球范围内新冠病毒变异毒株已经发现超1000种,包括Alpha、Beta、Gamma、Delta、Omicron等。特别是具有很强免疫逃避和传播能力的Omicron亚型,对控制当前新冠大流行构成了重大挑战。这些变异毒株导致现有疫苗的作用效价快速下降,因此急需开发更具广谱性的能够对抗变异毒株或泛沙贝科病毒(pan-sarbecovirus)的疫苗。
2022年11月10日,中国科学院昆明动物研究所郑永唐研究员联合福建师范大学欧阳松应教授和复旦大学姜世勃教授在Cell Research杂志上发表题为A variant-proof SARS-CoV-2 vaccine targeting HR1 domain in S2 subunit of spike protein文章。该研究以SARS-CoV-2的棘突(Spike, S)蛋白S2亚基中较为保守的HR1结构域为靶点,设计了重组蛋白疫苗HR121。该疫苗在转基因小鼠、金斑仓鼠以及恒河猴体内对SARS-CoV-2及其突变株的感染产生了近乎完全的保护,显示了完美的预防病毒感染和抗肺部炎症作用,并且具备可靠的安全性,有望作为当前以及未来对抗SARS-CoV-2突变的一个有前景的候选疫苗。

作为决定SARS-CoV-2传染能力以及致病风险的关键分子,S蛋白包含了S1和S2两个功能性亚基。其中S1通过受体结合域(receptor-binding domain, RBD)介导病毒与宿主细胞的受体结合;S2可把整个S蛋白固定在细胞膜上,并介导病毒与宿主细胞/细胞膜的融合,促进病毒基因进入宿主细胞内进行复制。S1亚基,特别是其中的RBD和N端结构域(N-terminal domain, NTD),能够诱导宿主产生中和抗体(neutralizing antibody, nAb),因此现有疫苗多数以此设计作用靶点。但是这种选择性作用于RBD等区域的方式同样也导致该区域的序列发生了大量突变,并逐步削弱当前一些疫苗的效力,因此急需研发作用于S蛋白中高度保守免疫位点的广谱疫苗。
与S1亚基不同,S2亚基在感染细胞前被覆盖在S蛋白内。S2亚基包含两个重要的结构域,七肽重复序列1和2(heptad repeat 1 and 2, HR1, HR2),这两个结构域在冠状病毒中高度保守。在该研究中,研究团队开创性地研发了一种靶向SARS-CoV-2中S2亚基膜融合中间态HR1结构域的新型重组蛋白疫苗HR121。该蛋白由HR1–HR2–HR1串联组成,HR121二聚化后其表面未结合HR2的HR1分子形成2个凹槽可作为抗原表位,高度模仿了S2亚基膜融合中间态的HR1三聚体内核构象,因此可诱导产生针对HR1的高效广谱中和抗体。
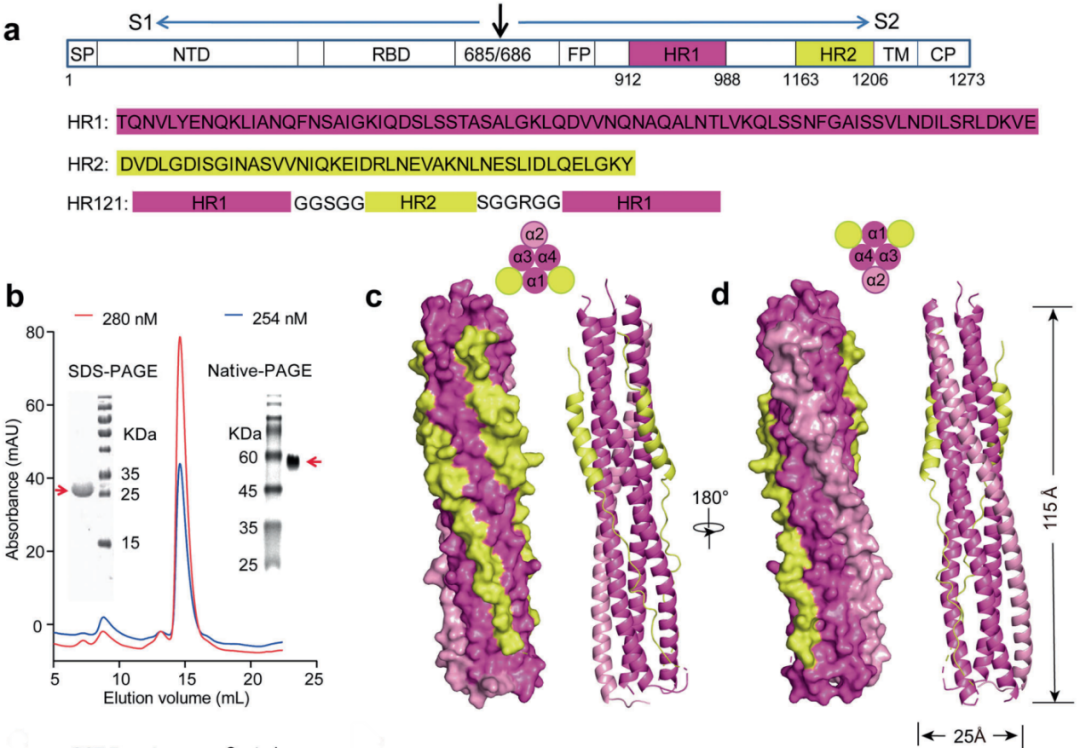
图1.重组蛋白疫苗HR121的结构特征
为了评估HR121的免疫原性以及是否可以作为SARS-CoV-2的疫苗抗原,作者利用HR121对新西兰白兔进行了免疫,HR121可诱导产生抗SARS-CoV-2及其主要变异株的强效广谱抗体,包括当前大流行的Omicron子代BA.1、BA.2、BA.3、BA.4和BA.5等。随后,作者进一步在人源化的ACE2转基因小鼠、金斑仓鼠以及恒河猴身上验证了HR121对SARS-CoV-2感染的保护作用。HR121免疫能够诱导这些易感动物模型产生高滴度的结合抗体和中和抗体,并为随后的SARS-CoV-2感染提供了近乎完全的保护,包括:在SARS-CoV-2攻毒后,动物体内没有复制活性的病毒存在,肺组织无病理改变等。并且,为了检测HR121疫苗对Omicron突变株的保护性,作者利用HR121分别与弗氏佐剂和铝佐剂混合后对金斑仓鼠进行了免疫,结果显示含有两种不同佐剂的HR121疫苗均可诱导较高滴度的结合抗体和中和抗体。利用Omicron变异株BA.2对其进行攻毒,观察到这两种不同佐剂的疫苗均可降低仓鼠肺部病毒载量(分别降低4.4和4个Log值),其肺组织同样无病理改变。此外,在所有体外或体内实验中,作者均未观察到HR121引起的抗体依赖的病毒感染增强效应。这些结果表明,HR121是一种很有前景的COVID-19候选疫苗。
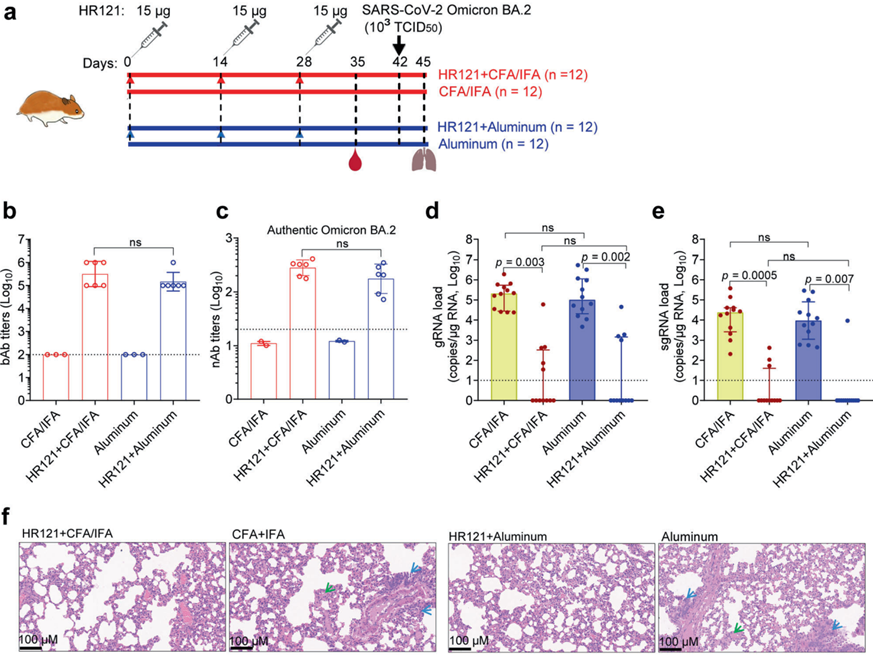
图2.含有不同佐剂的HR121疫苗均可有效保护金斑仓鼠免受Omicron BA.2感染的损害
综上,HR121能够模拟S2亚基膜融合中间构象中的HR1结构域,诱导产生对抗SARS-CoV-2及其主要变异毒株的高效广谱抗体。因此,它为开发新型COVID-19疫苗提供了一个极具应用前景的作用靶点。