5分钟学会细胞冻存技术

细胞冻存
细胞冻存是指将细胞放在低温环境,以达到减少细胞代谢的作用,从而达到对细胞进行长期储存进行保种的目的,以供后续实验或临床使用。
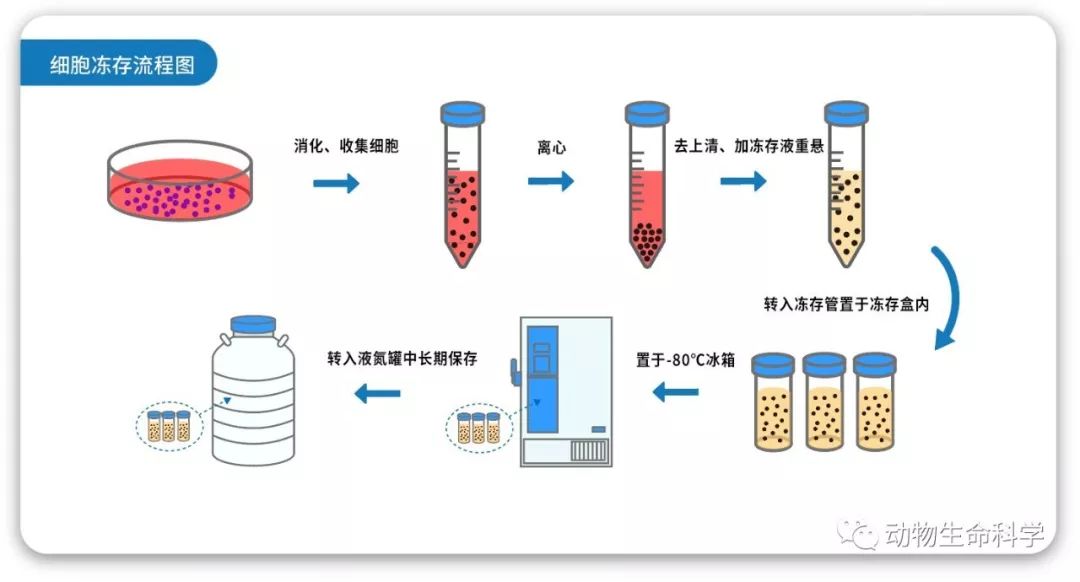
细胞冻存流程示意图
目前,细胞冻存主要的技术为液氮冷冻法,实际冻存过程中,需要进行梯度温度冻存,并加入适量的保护剂以保证细胞内外的水分不会形成冰晶造成细胞的损伤或死亡。
什么时候可以冻存细胞
在准备对目标细胞进行冻存前,一定要确保细胞处在最佳的生长状态,可通过以下几个指标进行观测:
1、培养基的颜色和浑浊情况
培养基的颜色可以指示细胞是否生长过盛(比如偏黄就说明细胞长的太过);而培养基出现浑浊情况往往是指示有污染存在,此时是不宜冻存的。
2、细胞培养的时间
通常情况下,新复苏的细胞建议在2周左右进行冻存,若连续培养超过二个月,性状大 概率会发生一些改变,此时的细胞也不适宜冻存。
3、细胞的数目
冻存时,每只冻存管内细胞最佳浓度为5x10^6个/ml—1x10^7个/ml,高密度或者低密度对细胞成活率都有一定的影响。细胞数目不足时,不建议冻存细胞。

细胞冻存前
需要做什么预处理吗
细胞被消化离心、去上清收集细胞沉淀后,往往需要用冻存液进行重悬并转移至冻存管。冻存液中一般含有渗透型的保护液如甘油或10%的二甲基亚砜(DMSO)和10%-90%胎牛血清。
细胞内外主要成分都是水,若不加保护液直接冻存,细胞内外的水分会凝结成冰晶,引发细胞内源性的机械损伤。细胞内水分凝结导致的细胞脱水,也会使得胞内pH值改变、蛋白变性、细胞内器官功能的丧失乃至核内DNA损伤,最终极有可能导致细胞的死亡。
而冻存液往往都是易溶解的小分子物质,具有细胞渗透性,可以穿过细胞膜,进入细胞内,降低冰点,同时又可以提高细胞膜对水的通透性,使得细胞内水分渗出到细胞外,从而减少细胞内冰晶的形成。
*某些特殊细胞如原代皮肤细胞也会额外添加海藻糖等表面型保护剂,以提高细胞存活率。
*由于DMSO对大部分细胞无毒性作用,因而在细胞冻存液中被广泛使用;也有少部分细胞部分细胞对DMSO毒性敏感,可以选用甘油作为冻存保护剂。
冻存液中的另一个主要成分是胎牛血清。由于冻存中的细胞仍旧有微弱的新城代谢,在冻存液中加入血清,可以为细胞提供营养。同时,血清中富含的蛋白等大分子物质可以对细胞有较好的保护作用。实验证明,血清在冻存液中的高比例,有利于提高细胞活力。因而,在冻存过程中可以使用90%的血清加上10%的保护液进行细胞保存。对于常见的易培养细胞系10%到20%的血清再加上一定量的完全培养基和DMSO也可以很好的对细胞进行保存。
细胞冻存的降温过程是怎样的
细胞冻存过程是一个梯度降温的过程,而其最终储存的最佳保冷介质为液氮。液氮的温度可以低至-196℃,在这种低温条件下,细胞的保存理论上是永久性的。
缓慢冻结的过程,能使细胞内水分在冻结形成冰晶前透出细胞,因此梯度降温可以大大减少细胞在降温过程中受到的损伤。目前,实验室通用的梯度降温方法以下两类:
1、人工传统降温法
冻存管置于4℃ 10 min → -20℃ 30 min → -80℃ 16-18 小时(或过夜,最长放置时间不要超过一个月)→ 转移至液氮长期储存。
*细胞置于4℃及-20℃的时间不可太长,且从4℃转移至-20℃时,最好颠倒混匀下细胞,防止细胞大量沉降堆积至管底,影响细胞复苏。
2、借助冻存盒、细胞渐冻仪等工具
利用其中的介质特性或制冷程序进行自主梯度降温:
冻存管置于细胞冻存盒(冻存盒需要提前预冷至4℃,需检查其内异丙醇或其他液体是否足量)后放于-80℃冰箱16-18 小时(或过夜,最长放置时间不要超过一个月)→ 转移至液氮长期储存。
冻存管置于渐冻仪中以1-2℃/min的降温速率降至-100℃后,→转移至液氮长期保存
使用液氮罐的安全小提示
液氮(Liquid nitrogen)是液化的氮气,是生命科学研究和医药行业常用的冷冻储存介质,具有以下理化性质:
01 超低温性:液氮的沸点为-195.8,液氮气化时每公斤可吸热 48 大卡;
02 无色、无臭、无毒的液体;
03 窒息性:氮气本身不能致使人窒息,但在一定空间内,如果氮气过多而隔绝氧气,操作者也会引起窒息。
因而,在操作液氮罐时,需要注意以下安全使用规范:
01 防止冻伤。虽然它渗透性很弱,但当人体皮肤接触液氮时会受到严重冻伤。在放置细胞时,一定要确保穿戴了厚手套、护目镜、实验服;
02 操作轻柔,防止液氮溅出;
03 尽可能地快速操作。由于液氮在空气中会迅速吸热气化,为了避免样品温度变化影响其质量,需尽快操作;
04 做好维护。定时查看液氮余量,确保罐内液体高度没过重要样品,最少时,液氮不可少于罐体容积的三分之一。