从分子克隆到细胞转染全解析
从分子克隆到细胞转染全解析
通过表达或者敲低来研究基因对功能的影响是细胞生物学中常用的手段,荧光蛋白的发现也为研究追踪细胞动态和变化提供了有效的工具。因此将某个基因引入细胞系,或者细胞系中敲除/敲低某个基因不可避免地需要经过转染这个过程。功能完整的质粒需要从分子克隆开始小心的设计,避免造成功能元件的缺失或者artifacts。本文从分子克隆开始讲述如何构建一个在哺乳动物细胞中正常表达的质粒,以及如何将该质粒递送(转染)到细胞系中。
分子克隆
分子克隆的目的是把自己想要表达的基因安装在表达载体上,这样表达载体转染进细胞后可以启动目的基因的表达。因此,表达载体或质粒,需要包含必须的几个原件来启动目的基因的表达,同时方便细胞转染后的筛选。
质粒的基本组成部分
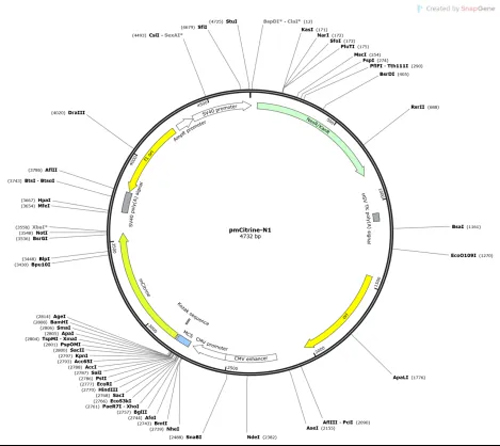
完整的质粒通常包括:启动子(promoter, 用以启动目的基因的表达),目的基因(GOI),终止子(terminator or polyA, 用以终止基因的表达),复制起始位点(ori, 用来质粒的扩增,真核表达载体有的含有两个复制起始位点包含质粒在大肠杆菌中扩增的ori和f1 ori),抗性基因(用来在大肠杆菌和细胞中筛选阳性克隆)。有的真核细胞表达载体还含有其他原件,用来增强基因表达过程中的稳定性(如AAV载体中的WPRE),方便病毒包装(AAV和lenti载体中的两端重复序列),控制多个基因表达(IRES和P2A元件等)。有的还会同时表达荧光蛋白方便后期细胞的筛选。经典的质粒图谱如下(由SnapGene生成):
分子克隆
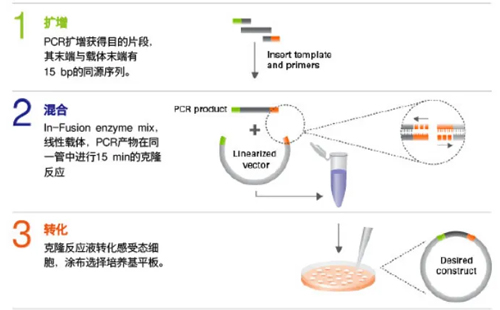
分子克隆类似于打补丁,把其他地方得到的目的基因通过PCR或者酶切的方式得到,并粘贴到一个需要的表达载体上。因此整个过程设计PCR,酶切,片段回收,连接转化,测序,质粒扩增和抽提。简短的示意图以Takara的In Fusion为例:
1. PCR
PCR的目的是为了得到可以用来连接的目的基因,通过两端引物的扩增得到自己想要的目的序列,在这个过程中可以通过引物的设计添加或者删除酶切位点,引入突变位点等。需要注意的是,如今市面上多种多样的高保真酶可以确保碱基突变的概率很低,甚至可以用这些高保真酶扩增长片段,高GC,多序列重复的载体序列。
2. 酶切
得到的PCR产物需要插入到自己的表达载体上,通常质粒为超螺旋闭环状,因此需要合适的限制性内切酶切开对应位点,以方便目的基因的插入。切开的质粒通常需要回收骨架部分,舍弃掉原来位置上的基因。建议使用NEB家的限制性内切酶,没有星号活性,Buffer基本通用,可以灵活的调节和控制酶切反应及时间。对于没有想要的酶切位点的载体,可以利用步骤1中的PCR方式获取。
3. 片段回收
为了获得高纯度,去除反应液中的离子,通常需要DNA琼脂糖凝胶电泳来回收酶切或PCR得到的目的基因和载体(胶回收)。通常最后的洗脱用去离子水或者双蒸水,以方便下一步的使用。
4. 连接转化
常用的分子克隆手段有很多,如普通的酶切连接(依赖T4 DNA 连接酶),In Fusion (依赖于外切酶),GoldenGate (依赖TypeIIS型限制性内切酶创造的独特切口),Gibson组装(外切酶,聚合酶,连接酶同时作用),CPEC(高保真DNA聚合酶)等。连接转化后的产物通常转化到感受态细胞中,以获得单克隆。
5. 测序
重组得到的单克隆菌落有的时候会有错配或者突变,碱基的缺失等,因此需要挑选单克隆菌落测序。通常测序前会通过菌落PCR和酶切验证,但是如前所说,现在的DNA高保真聚合酶大大减少了突变的发生,而目前的连接方法组装正确率都很高,因此为节约时间,我选择平板随机挑选两个菌落送测。
6. 质粒扩增和抽提
测序成功的质粒可以重新转化感受态,挑取单克隆培养后选择小提/中提/大提质粒。值得注意的是,用于转染的质粒最好使用去内毒素质粒提取盒。
转染
转染前的准备
转染之前需要准备细胞,一般细胞复苏后传1-2代观察形态和状态,如果条件严格的话还需要检查是否有支原体污染或者黑胶虫等。细胞状态良好的,形态完整活力较好的,汇合度达到80-90%后可以接种细胞。接种细胞前需要计数,有条件的推荐RWD家的细胞计数仪。以293T为例一个示意的形态图(汇合度>90%)和细胞状态如下:
转染
经典的转染方式包括磷酸钙,脂质体(以Thermo的lipo2000/3000为代表),PEI (25, 0000 or 40, 000),慢病毒侵染等,每周转染方式大同小异,具体原理就不一一赘述。以下以经济实用的PEI转染为例:
1. 准备试剂
无血清培养基(DMEM or opti-MEM), PEI (1mg/mL),待转染的DNA质粒。2. 准备DNA-PEI复合物
以24孔板为例,500ng的DNA稀释到50ul的无血清培养基中,然后按1:3(1μg DNA : 3μL PEI)的比例加入PEI (需要自己调试PEI的比例1:1-1:5,和细胞类型和不停品牌的PEI质量都有一定关系),混匀后静止15min,一次性将复合物滴入到待转染的孔。
3. (可选)
6-8小时后去除培养基,更换为新鲜的完全培养基(DMEM+10% FBS)。4. 24小时后荧光显微镜下观察转染结果
通常转染效率很高,大于90%:
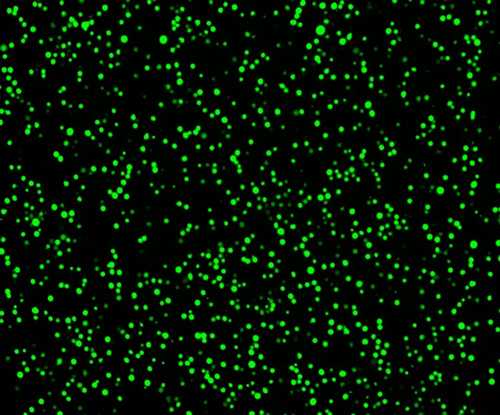
瑞沃德细胞计数仪,5倍镜下状态
总结
现在的分子克隆和细胞转染的教程很多,而且很多商家的产品都会有详细的介绍,从原理到具体操作。本人推荐常用到的几个网站和学习资源,如SnapGene,Addgene, Takara官网,Thermo和NEB,FuGENE, ATCC。他们基本上是分子和细胞领域的权威和产品创新者,很多国内的产品都是在此基础上做出来的平替。这些网站无论是在宣传还是产品介绍上都给出了很权威且详细的介绍。