小鼠眼球注射实验操作和方法,让你的科研更进一步!
背景:
目前在全球范围内因为眼部疾病致盲人数约有4000万,这其中有相当一部分属于遗传性视神经病变,如老年黄斑变性、Leber先天性黑朦、Leber遗传视神经病变等等。
随着基因疗法的兴起,通过腺相关病毒(AAV)、慢病毒(LV)等作为药物递送载体,对遗传性眼部疾病进行基因修正已经取得许多重大进展,越来越多的基因药物被开发出来,而小鼠作为常用的药物筛选模型,在基因治疗的临床前研究中占据重要地位。
眼球作为相对独立的器官,球内注射是最有效的药物递送方式。眼球注射可突破血眼屏障,使药物迅速浓集于眼内, 继而在眼内扩散到达作用部位。具有代表性的眼内注射给药途径有视网膜下(subretinal)注射和玻璃体腔(Intravitreal)注射,玻璃体内注射能够使基因药物可以较快扩散至视网膜或脉络膜部位,如临床上常用于老年性黄斑变性的药物输送;视网膜下注射可将药物直接传递到视网膜和视网膜色素上皮细胞(RPE)之间的潜在空间,是将药物直接递送至RPE细胞的最 佳方法。
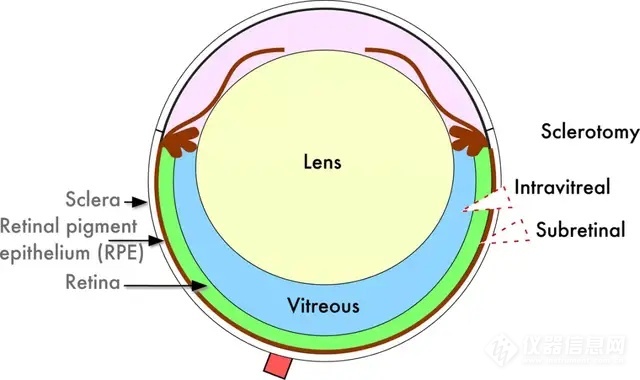
玻璃体注射和视网膜下注射示意图
一、视网膜下注射
实验仪器耗材:
手术器械、吸入式麻醉机、Hamilton注射器(30G、33G)、托品酰胺、去氧肾上腺素、手术显微镜
实验步骤:
1. 动物麻醉
1) 小鼠置于诱导盒内进行吸入式异氟烷麻醉,捏合小鼠脚指确认是否麻醉完全
2) 将老鼠转移到解剖显微镜下,连接鼻锥持续给予异氟烷
3) 待注射眼睛滴加一滴丙美卡因(或类似的表面麻醉剂)防止注射引起局部反射,轻触结膜确定麻醉深度。
2. 扩瞳
1) 倾斜鼠标头部,使待注射眼睛在视野范围内,用棉签擦去任何多余的液体
2) 向待注射眼球滴加1-2滴1%托品酰胺和0.5%去氧肾上腺素用于扩大瞳孔
3. 巩膜切口
1) 使用镊子在上下眼睑之间滑动,使眼球从眼窝中伸出,暴露巩膜
2) 采用30G针头在角巩膜缘后面做一个小的巩膜预切口,如果液体从切口处流出,则针头穿刺过深而进入玻璃体腔,之后注射过程中的液体可能进入玻璃体腔
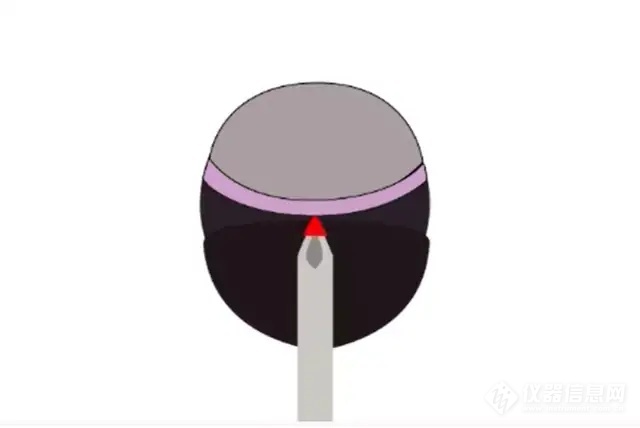
角巩膜缘稍后处切口示意图
4. 注射
1) 用镊子轻轻捏紧缘下约1mm处的结膜保持眼球固定
2) 将装好注射液的33G注射针插入预切口,针与眼球表面相切,沿巩膜内表面穿过,尖 端进入约1mm,穿过巩膜和脉络膜,到达视网膜下间隙
3) 操作注射器平稳注入适量液体,注意注射过程避免晃动引起额外的组织损伤
4) 注射后,停留针头约30秒,以防漏液,然后将针头慢慢抽出
5) 取出镊子,重新放置结膜,轻轻将眼睛放回眼窝,闭上眼睑
6) 如果需要双侧眼球注射,将另一面眼球转到显微镜视野下重复上述步骤
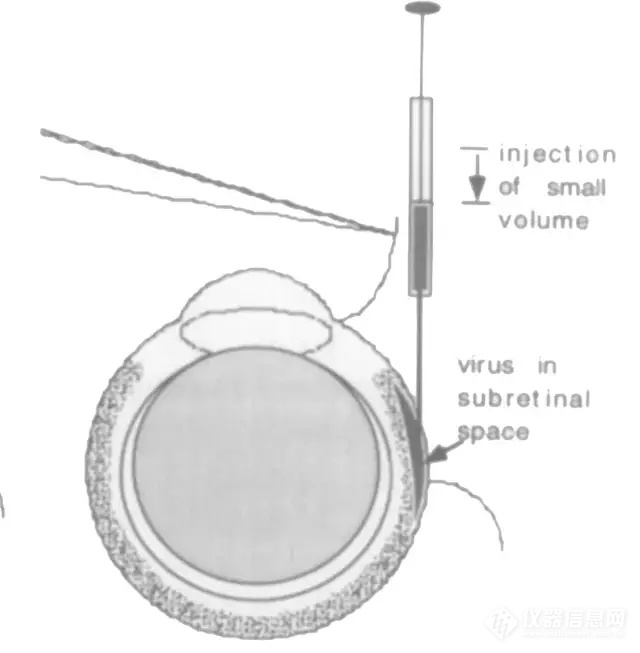
视网膜下注射进针示意图
R480玻璃电极注射泵搭配显微操纵器可满足大小鼠眼球精 准注射实验,采用更细的玻璃毛细管代替常规33g注射针头保证更小的注射损伤

5. 恢复
1) 可在角膜和注射区域涂抹抗生素眼药膏防止感染
2) 将动物放在加热垫上使其完全恢复(2-3分钟),然后将其转移回笼子继续饲养
二、玻璃体内注射
玻璃体内注射与视网膜下注射类似,在用镊子保持眼球稳定的同时,将装好药物的针头,相对视神经约60度角,从角巩膜缘(Limbus)后预切口,插入约1mm进行玻璃体腔注射。需要注意晶状体占据玻璃体腔的大部分,应小心避免刺穿晶状体。
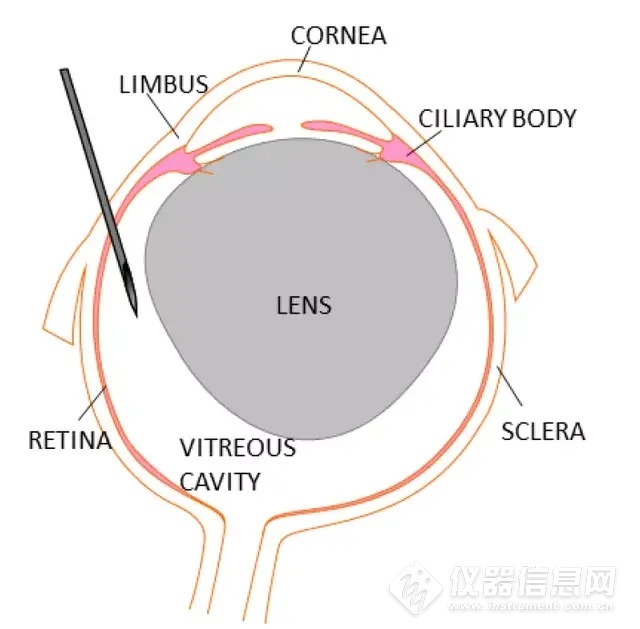
玻璃体腔注射进针示意图
注意事项:
1)眼球注射过程应确保动物眼睛一直湿润,避免角膜干燥,可根据需要多次使用润滑滴眼液。
2)注射过程应缓慢进行,避免速度过快造成液体从注射部位回流
3)眼球注射前应充分扩瞳,瞳孔过小不易看清眼底,会降低注射成功率,同时瞳孔过小也是虹膜出血的主要原因
4)角膜穿刺点靠近角巩缘处为好,以免形成角膜白斑而影响后续动物实验
5)视网膜下注射,注射针插入切口部位,应平行于眼外壁推进,保证准确进入视网膜下空间,如果太靠近外壁或太深,将会导致注射针进入错误位置。