靶向性癌症治疗新探索!Cancer Immunol Res:IL3 介导细胞毒性 T 细胞 - 嗜碱性粒细胞互作增强抗肿瘤免疫
在癌症治疗领域,免疫疗法的发展为患者带来了新的希望。然而,肿瘤微环境(Tumor microenvironment, TME)对免疫细胞功能的复杂影响,常常限制了免疫治疗的效果。细胞毒性 CD8(+) T 淋巴细胞(CTLs)在肿瘤免疫防御中扮演着关键角色,但在 TME 的作用下,它们可能逐渐衰竭,丧失抗肿瘤能力。

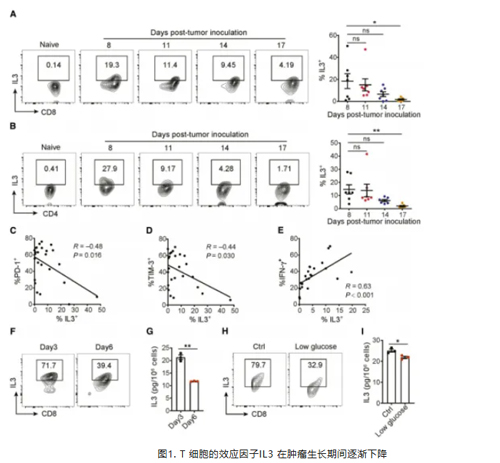
作者利用 B16 黑色素瘤模型来探究肿瘤进展过程中 T 细胞的衰竭情况。随着肿瘤的生长,PD1 和 TIM-3 的表达增加,而 T-bet 与效应细胞因子(IFNγ、TNFα 和 IL2)的产生减少,这表明在肿瘤生长过程中 T 细胞逐渐衰竭。同时,研究发现体外激活的 CD8(+)和 CD4(+) T 细胞表现出IL3高表达,且早期肿瘤中的 CD8(+)和 CD4(+) T 细胞的出现伴随有大量 IL3 产生,但随着肿瘤发展,IL3 逐渐减少。进一步实验发现,在模拟 TME的低葡萄糖和持续激活条件下培养 CD8(+) T 细胞,其 IL3 表达和分泌减少,说明 TME中的葡萄糖剥夺是导致 T 细胞在持续抗原刺激下 IL3 减少的一个重要因素。(图1)
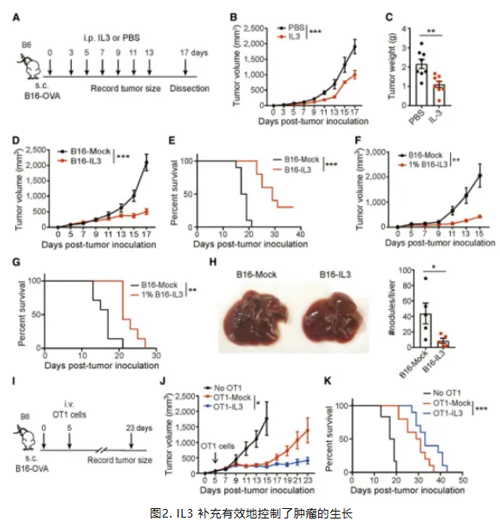
作者进一步探究补充IL3是否能够消除肿瘤生长。对荷瘤小鼠腹腔注射IL3 ,或对肿瘤细胞进行基因改造过表达 IL3,均显著抑制肿瘤生长。即使只有1%的肿瘤细胞过表达 IL3,也能显著抑制肿瘤生长,并且在转移性黑色素瘤模型中,补充IL3减少了肝转移结节的形成。此外,将过表达 IL3 的 OT1 细胞输入到荷瘤小鼠中也能抑制肿瘤生长并延长宿主生存。这些数据表明,无论是单独补充IL3 还是与 T 细胞作用相结合,都能有效控制肿瘤生长。(图2)
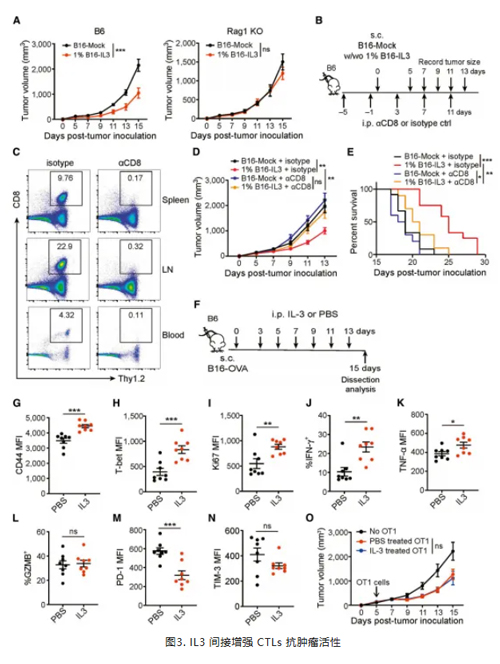
虽然 IL3 补充有效地抑制了肿瘤生长,但其机制尚不明确。作者探究发现,IL3 介导的抗肿瘤活性依赖于淋巴细胞的功能,在缺乏成熟 T 和 B 细胞的 Rag1 KO 小鼠中未观察到这种抑制作用。清除掉小鼠模型中的 CTLs ,则消除了 IL3 对肿瘤生长的抑制和对生存的改善。这表明CTLs 在 IL3 介导的肿瘤控制中发挥关键作用。
作者进一步探索发现,补充IL3 可观察到CTLs 的 CD44、T-bet、增殖标志物 Ki67、IFNγ 和 TNFα 表达增加,PD1 表达下降, TIM3 表达有一定程度的降低,但对颗粒酶 B 无影响。此外,IL3 处理的 CD8(+) T 细胞在代谢、效应功能、活力和体外抗肿瘤能力方面与对照组相似,这表明 IL3 并非直接作用于CD8(+) T 细胞增强其抗肿瘤免疫活性,而是通过间接机制发挥作用。(图3)
作者团队在研究期间发现,IL3介导的CTLs 抗肿瘤活性增强可能涉及中间细胞群的参与。与纯化的 CD8(+) T 细胞(pCD8)相比,与脾细胞共培养的CD8(+) T 细胞(bCD8)表现出以糖酵解为主的代谢模式、 IFNγ 产生和存活能力增强,并且过继转输到荷瘤小鼠中后,bCD8 OT1细胞的抗肿瘤免疫活性更强。通过 transwell 系统研究发现,其他细胞群释放的可溶性因子介导了 CD8(+) T 细胞效应功能的增强。T 细胞产生的可溶性效应因子作用于某些非 T/B 细胞亚群,继而改善 CTLs的效应功能。IL3 在其中起到了介导 T 细胞和非 B/T 细胞互作的关键作用。(图4)
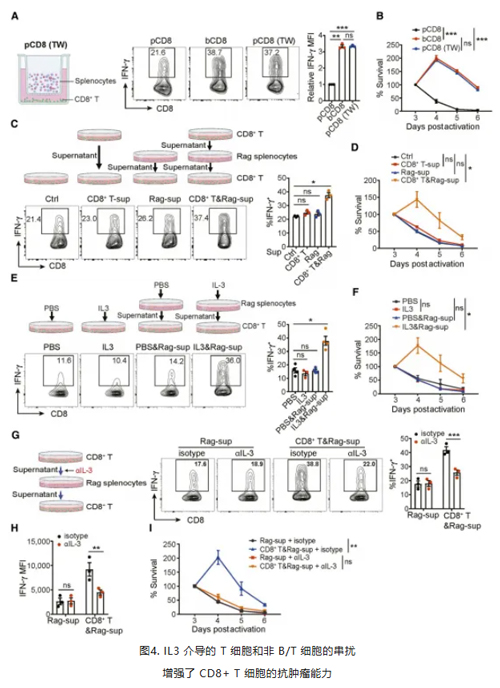
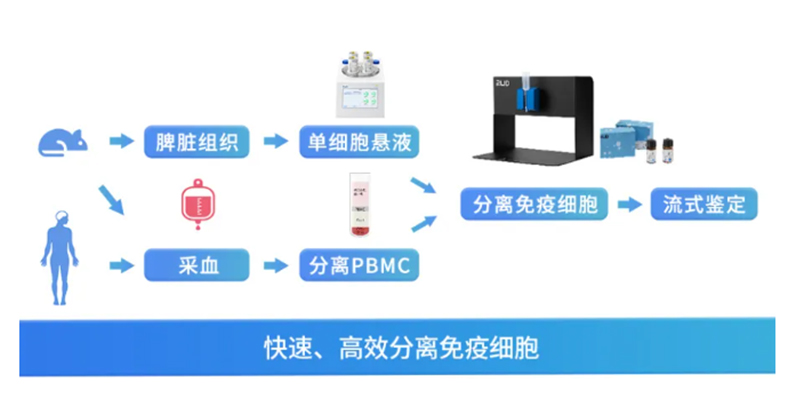
(作者用到瑞沃德纳米磁珠细胞分选系统分离纯化CD8+T细胞)
为确定 IL3 的细胞靶点,作者从 Rag1 KO 小鼠脾脏中分离出不同细胞群进行评估,发现只有经 IL3 处理的 CD45(+)Lin(–)细胞培养基增强了 CD8(+) T 细胞的 IFNγ 产生。同样,经 IL3 处理的瘤内来源 CD45(+)Lin(–)细胞的条件培养基增强了 CTL 的 IFNγ 产生和活力。
其中,嗜碱性粒细胞作为 CD45(+)Lin(-)白细胞的一个亚群,表达高水平的 IL3 受体,IL3 处理嗜碱性粒细胞可促进 CD8(+) T 细胞的 IFNγ 产生和活力。此外,补充 IL3 显著增加了小鼠脾脏和肿瘤中的嗜碱性粒细胞数量,清除嗜碱性粒细胞则降低了 IL3 补充的抗肿瘤功效,从 B16-IL3 黑色素瘤荷瘤 Rag1 KO 小鼠脾脏中分离出的嗜碱性粒细胞能够限制肿瘤生长。这些结果表明,IL3 激活的嗜碱性粒细胞在增强抗肿瘤免疫方面发挥关键作用。(图5)
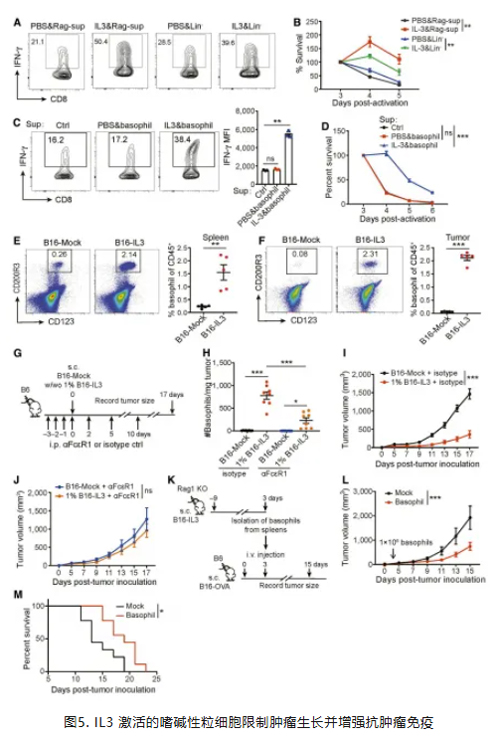
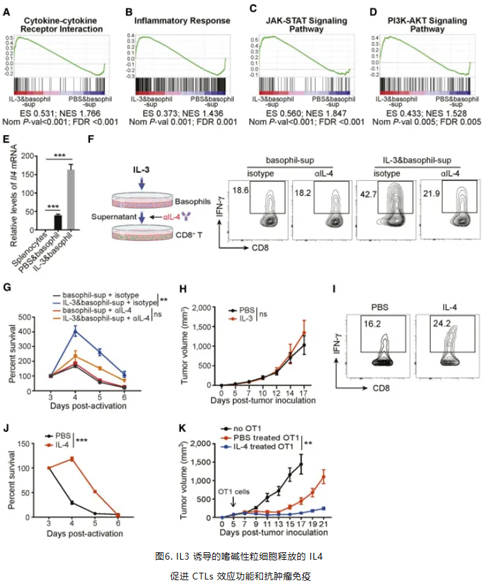
作者进一步通过RNA-seq 和相关通路分析发现,IL3 处理的嗜碱性粒细胞的条件培养基增强 T 细胞的功效可能是由 IL4 级联信号的激活引起的。IL3 处理会显著增加嗜碱性粒细胞中 Il4 基因的表达, 使用中和抗体阻断IL4则显著削弱了 IL3 处理的嗜碱性粒细胞条件培养基对 CD8(+) T 细胞的作用。向Il4 基因敲除的小鼠模型注射IL3对肿瘤生长无影响。而IL4 处理则重塑 CD8(+) T 细胞的代谢,提高了其 IFNγ 产生和存活能力,并且过继转移 IL4 处理的 OT1 细胞显著减少肿瘤体积。这些发现表明,IL3 处理后的嗜碱性粒细胞产生更多的 IL4 ,增强了 CTLs 介导的抗肿瘤免疫。(图6)
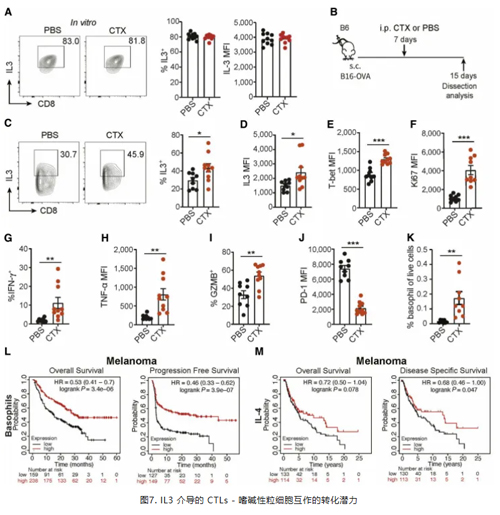
为更好地应对临床上癌症治疗,作者还评估了化疗药物对IL3 表达或效应功能的影响,以及IL3介导的免疫细胞互作在黑色素瘤患者预后中的作用。以上数据表明,靶向 IL - 3 介导的细胞毒性 T 淋巴细胞-嗜碱性粒细胞互作机制,可能是增强抗肿瘤免疫和改善患者预后的一个有效途径。(图7)
研究方法亮点
这项工作深入探究了IL - 3 介导的细胞毒性 T 淋巴细胞 - 嗜碱性粒细胞串扰机制,综合运用多种实验模型和技术,包括细胞培养、动物实验、基因工程、细胞分选和分子生物学检测等,全面深入地揭示了 IL3 在肿瘤免疫中的复杂作用机制,为理解肿瘤免疫抑制提供了新的视角。
在该研究中,研究人员采用了瑞沃德生产的纳米磁珠细胞分选产品。此外,瑞沃德还可提供的该研究所涉及的原代细胞提取、细胞纯化等,肿瘤治疗相关临床前研究实验技术的完整解决方案。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全球2500+医院,1000+科研院所,6000+高等院校,已助力全球科研人员发表SCI文章14500+,获得行业广泛认可。