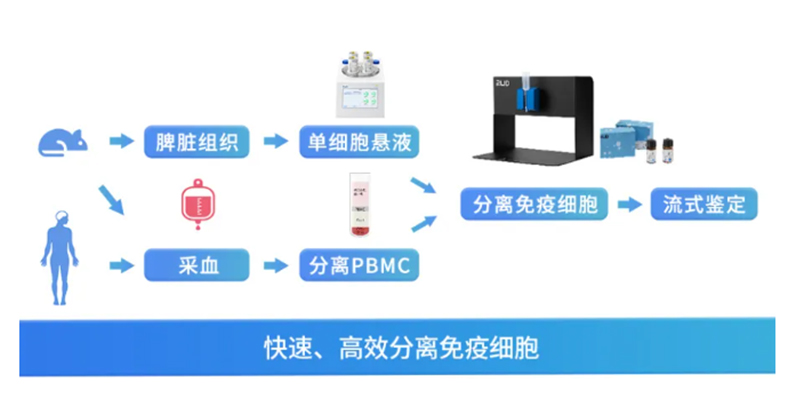
巨噬细胞的抗/促炎活性探究筛选
巨噬细胞的抗/促炎活性筛选
巨噬细胞作为天然免疫系统中的细胞,其存活时间长,具备吞噬能力,与中性粒细胞同为感染的第一反应者。该细胞主要参与细胞碎片和病原体的识别、吞噬和降解,向T细胞呈递抗原以触发适应性免疫应答。而且,巨噬细胞也能诱导其它抗原呈递表达共刺激分子,从而启动适应性免疫反应。
在炎症早期阶段,巨噬细胞会释放多种细胞因子与趋化因子,以此吸引更多免疫细胞招募至炎症部位,发挥关键作用。
因此,深入研究巨噬细胞对药物的响应机制,有助于研发新型抗炎疗法,特别是针对炎症相关疾病,如自身免疫性疾病、过敏症及动脉粥样硬化等。
实验方法与参考结果
材料和试剂
• 细胞系:小鼠单核巨噬细胞系Raw264.7
• 试剂:DEME细胞培养基、磷酸盐缓冲液(PBS)、胎牛血清(FBS)、脂多糖(LPS)、一氧化氮合酶抑制剂(L-NMMA)、细胞因子试剂盒、四噻唑蓝(MTT)、二甲基亚砜(MTT)。
抗炎实验
• 细胞铺板
将生长状态良好的Raw264.7细胞,按照5x105个/mL细胞密度接于96孔板中,置于37 ℃,5% CO2的恒温培养箱中培养,待细胞生长至50%左右时,用100 μL不含FBS培养基代替旧培养基,饥饿处理12 h后,分为三组:(1) 空白对照组:仅含细胞和培养基;(2) LPS模型组:LPS终浓度为1 μg/mL;(3) 实验组:分别加入梯度浓度的待测样品和1 μg/mL的 LPS。每组均设3个复孔,每孔加入DEME完全培养基100 μL。在含5% CO2饱和湿度培养箱中保持37 ℃恒温培养24 h后,进行RAW264.7细胞形态观察,并通过MTT法测定细胞活力。
• Griess法检测NO生成量
细胞处理操作如上所述,饥饿处理12h后,分为四组:
(1) 空白对照组:仅含细胞和培养基;
(2) LPS模型组:LPS终浓度为1 μg/mL;
(3)阳性药对照组:加入50 μM L-NMMA和1 μg/mL的LPS;
(4) 实验组:分别加入梯度浓度的待测样品和1 μg/mL的 LPS。
药物孵育24 h后,取50 μL上清液,加入另一96孔板中,加入等体积的室温Griess试剂Ⅰ和试剂Ⅱ,轻轻混匀后,室温放置10 min, 酶标仪检测540 nm处吸光度,根据标准曲线计算细胞分泌的NO水平。
NO标准曲线的绘制
以1 mM的NaNO2溶液配制,以dd水稀释得到5、10、20、40、60、100 μM梯度浓度的标准溶液。取各浓度梯度下的NaNO2溶液50 μL于96孔板中,于室温下操作,分别加入相同体积的Griess试剂Ⅰ和试剂Ⅱ,轻轻混匀后,放10 min,酶标仪检测540 nm处样品的吸光度,以NO摩尔浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
计算NO抑制率:NO抑制率=(LPS处理组-实验组)/LPS处理组×100%
• ELISA试剂盒检测炎症因子生成量
细胞处理操作如上所述,将药物孵育24 h后的细胞,弃掉培养基,以预冷的PBS润洗3次,洗去残留的培养基,加入适量细胞裂解液,低温震荡裂解10 min。以移液器吹打裂解后的细胞,将裂解液移至离心管中,于4℃下12000 rpm离心5 min。离心后的上清分别采用细胞因子试剂盒进行检测,可选择细胞因子种类:COX-2、TNF-α、IL-1β、IL-2和IL-6。
• qRT-PCR检测iNOS、TNF-α表达量
细胞处理操作如上所述,将药物孵育24h后的细胞,弃掉培养基,以预冷的PBS润洗3次,洗去残留的培养基,加入Trizol裂解细胞,于无菌环境中提取细胞总RNA,使用琼脂糖凝胶电泳检验RNA的降解情况。将获得的未降解RNA作为模板,反转录合成cDNA,以所得cDNA为模板,GAPDH为内参,加入对应引物,用SYBR Green Ⅰ荧光染料检测法进行扩增,检测细胞中iNOS、TNF-α的mRNA的水平。
• Western Blot检测NF-κB蛋白及相关因子的表达量
细胞处理操作如上所述,将药物孵育24 h后的细胞,弃掉培养基,以预冷的PBS润洗3次,洗去残留的培养基,加入适量细胞裂解液(裂解液配方:50 μL=40 μL RIPA+5 μL磷酸酶抑制剂+0.5 μL PMSF,每100 mg组织加1 mL裂解液),于冰上震荡裂解10min,将裂解液以12000 rpm离心30 min,收集裂解液。BCA测定蛋白含量,根据最低蛋白浓度样品(不要低于2 mg/mL,5 mg/mL会很好跑出条带),以PBS和5X Loading Buffer进行调平。沸水浴10 min灭活,分装,-80 ℃保存。选择合适浓度的SDS-PAGE胶分离,每孔上样40 mg蛋白量(根据调平的蛋白浓度计算上样体积,注意,上样体积必须相同且对称,否则需以loading buffer补齐)。浓缩胶区域时设置电压60 V,以压平条带,进入分离胶区域后设置电压120 V,临结束前设置电压60 V,再次压平条带。湿转蛋白条带至PVDF膜上,脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,PBST洗涤三次后,二抗孵育2 h,PBST洗涤三次,ECL发光显色观察,检测各组蛋白表达量的变化。
促炎实验
促炎实验方法与抗炎模式相同,区别在于,设置细胞分组为:
(1) 空白对照组:仅含细胞和培养基;
(2) LPS模型组:LPS终浓度为1 μg/mL;
(3) 实验组:分别加入梯度浓度的待测样品,从而比较药物与LPS的促炎效果。
实验结果及讨论(以促炎实验为例i)
细胞形态观察
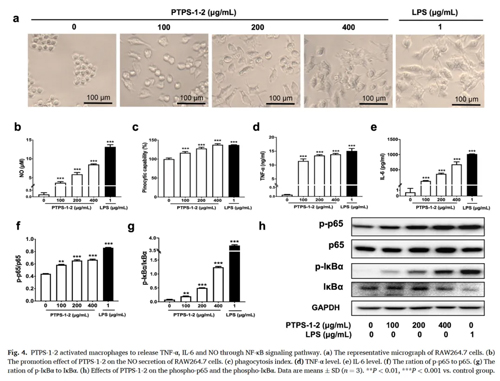
Raw264.7细胞形态主要为圆形。因其对环境非常敏感,在培养时会出现少量短梭形或多角形的分化细胞,而受到药物处理后,如果药物具有免疫刺激活性,其分化程度和比例进一步增多,整体表现为梭形,存在明显触角。如图a可见,不做任何处理的巨噬细胞为圆形,随着药物浓度升高,更多的细胞形态逐渐变成梭形,触角伸长,LPS处理组的细胞形态变化明显。
NO生成量
LPS作为强免疫原性颗粒,是炎症模型中广为应用的诱导剂。NO是一种重要的内源性信号分子,由巨噬细胞、T淋巴细胞、自然杀伤细胞等免疫细胞产生,具有防御病原体、调节免疫细胞功能、调节免疫代谢、诱导细胞凋亡等重要作用。如图b可见,LPS处理后NO分泌上调,药物组的NO分泌量表现出剂量依赖性,说明药物具有促炎活性。
TNF-α、IL-6表达量
TNF-α是主要的促炎细胞因子,由多种细胞类型分泌,包括巨噬细胞、单核细胞、中性粒细胞、CD4+T细胞和NK细胞,IL-6是一种多效性细胞因子,参与免疫反应以及炎症、造血、骨代谢和胚胎发育,由淋巴细胞、巨噬细胞和单核细胞分泌产生。如图d, e可见,药物表现出与LPS同等效力的TNF-α诱导效果,药物对IL-6的诱导分泌具有剂量依赖性。
参考文献
iXu等, 《An Arabinogalactan Isolated from Pollen Typhae Induces the Apoptosis of RKO Cells by Promoting Macrophage Polarization》.