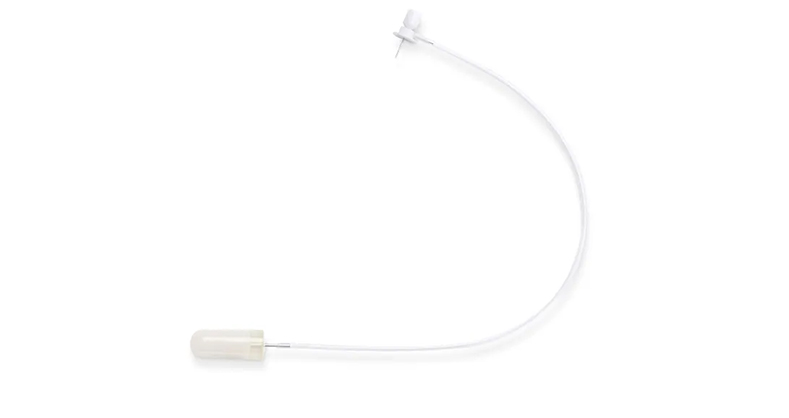
鞘内给药置管方法全集,这些要点快来了解!
一、小脑延髓池置管
1 实验仪器耗材
脑立体定位仪、体视手术显微镜、吸入式麻醉机、加热垫、手术器械、缝合线、70%酒精、组织粘合剂、32G鞘内PU导管(带结节用于锚定组织)等。
2 实验步骤
麻醉
1,小鼠置于诱导盒内给予4%的异氟烷麻醉。
2,确认老鼠在失去反应能力后,用电动剃须刀将动物颈部到头部的的皮肤脱毛。
3,将耳杆正确插入小鼠耳道进行定位仪固定,嘴部置于口部麻醉面罩上以持续麻醉(2%异氟烷),加热垫(37℃)维持体温。
4,70%乙醇擦拭剃毛部位皮肤进行消毒,可涂抹眼药膏保护小鼠眼睛。
暴露寰枕膜
1,手术刀沿颈部中线(枕骨嵴处)做一个2-3厘米长的纵向皮肤切口。
2,继续沿皮肤切口向下切开枕骨上方肌肉,用手术挂钩将肌肉从枕骨拉至两侧固定,暴露寰枕膜。
3,显微镜视野下用剪刀小心地在寰枕膜开一个缝,暴露脑干。此时脑脊液会从由此切口渗出。注意寰枕膜切口要尽可能浅,避免损伤脑干。
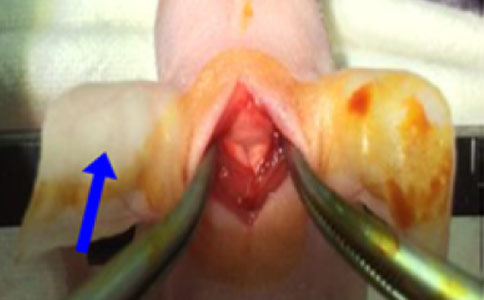
寰枕膜解剖图[1]
置管
1,移动定位仪面罩,调整小鼠头部,使头部朝下与身体成90度角。
2,将导管修剪到所需长度,显微镜视野下轻轻将导管插入延髓池。保持导管角度与脑干的背侧表面平行,向尾部方向缓慢推进到脊柱内所需位置。
3,采用组织粘合剂将导管结节固定在颅骨上,取出手术挂钩缝合两边肌肉进一步稳固结节,确保鞘内导管长期稳定。
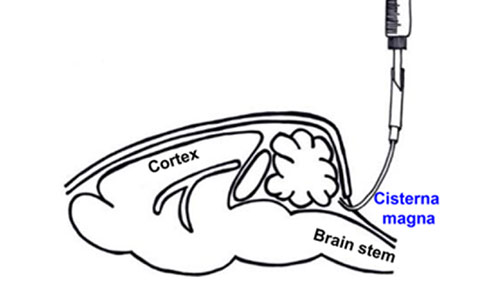
小脑延髓池(cisterna magna)置管[1]
可选操作:缓释泵鞘内给药
1,选择缓释泵鞘内给药方式需预先进行缓释泵灌充、鞘内导管连接、泵体孵育等准备操作参考。
2,用止血钳自颈背部切口分离背部皮下组织,打通皮下隧道形成空隙。
3,将植入式缓释泵放置空隙中,使用缝线将所有皮肤切口缝合完整。
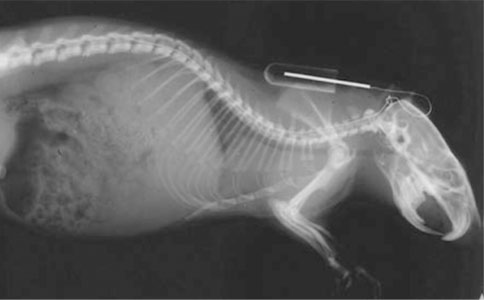
缓释泵小脑延髓池置管输注[2]
术后恢复
1,可在术后给予腹腔注射5%葡萄糖,补充能量
2,为预防术后感染,可服用预防性抗生素如恩诺沙星等。
3,定期检查小鼠是否有肢体功能障碍、疼痛或手术不良反应,剔除影响实验的不良个体。
注意事项
1,切开寰枕膜时很容易损伤脑干,要尽量从表面切开,注意不要压迫脑干,可能会导致呼吸抑制。
2,将头部屈曲90°角对于导管正确进入延髓池及后续插入非常关键。
3,导管插入过程必须注意确保动物脊椎笔直,可以通过轻拉尾巴施加张力以使脊椎对齐。
4,注意切割方向应与动物背部平行,避免损伤深层肌肉层或其他组织结构。
二、腰椎脊髓鞘内置管
1 实验仪器耗材
体式手术显微镜、吸入式麻醉机、加热垫、钻子、手术器械、缝合线、70%酒精、组织粘合剂、32G鞘内导管(带结节用于锚定组织)等。
2 实验步骤
麻醉
1,小鼠置于诱导盒内给予4%的异氟烷麻醉。
2,确认老鼠在失去反应能力后,用电动剃毛刀将背部皮肤脱毛
。
3,持续给予麻醉(2%异氟烷),将小鼠置于加热垫(37℃)维持体温。
4,70%乙醇擦拭剃毛部位皮肤进行消毒,可涂抹眼药膏防止眼睛干燥
暴露脊柱
1,用手术钳和手术刀在背部中线处做一个2-3厘米长的纵向皮肤切口。
2,识别第六腰椎(L6)的脊柱突,用手术刀切开L6-L2脊柱突周围肌筋膜。用镊子将肌肉组织从椎板中分离出来,用手术挂钩将肌肉拉至两侧固定,暴露L6/L5椎板。
3,显微镜视野下用钻子在椎板上钻孔直到剩下薄骨层,避免钻透。脊髓组织此时可以透过骨层看到。
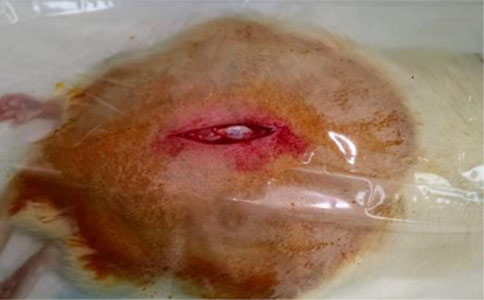
腰椎切口示意图[3]
置管
1,显微镜视野下小心将钻孔切开小缝,此时脑脊液会由此切口渗出。注意避免脊髓或其血管受伤。
2,将导管修剪到所需长度,在显微镜视野下将导管轻轻插入鞘内间隙。保持导管角度始终平行于脊髓,向头部方向缓慢推进到脊柱内所需位置。
3,取出手术挂钩缝合两边肌肉将导管结节稳固在肌肉内,确保鞘内导管长期稳定。
4,用止血钳自背部皮肤切口往小鼠头部方向分离背部皮下组织,打通皮下隧道,将导管回绕顺着皮下隧道从颈部穿出。
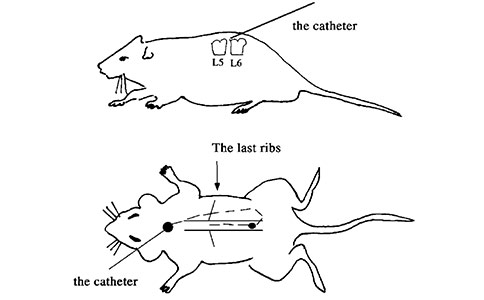
腰椎置管[4]
可选操作:缓释泵鞘内给药
1,缓释泵准备工作同上
2,用止血钳自背部皮肤切口往小鼠头部方向分离背部皮下组织,打通皮下隧道形成空隙。
3,将植入式缓释泵放入空隙中,注意此时泵体应该处于胸背部,缓释泵流量调节器应该对准尾巴方向(注意不能往尾部方向打通隧道,因为将泵体放置在髋骨上方,可能引起局部骨刺激)。
4,使用缝线将所有皮肤切口缝合完整。
恢复
同上所述
注意事项
1,导管插入过程必须确保始终平行于脊髓。这样有利于插入,同时降低神经损伤风险。
2,导管插入较小的鞘内间隙如中段胸椎脊髓时,可能引起脊髓炎症和压迫,应特别小心。
3,正确的导管插入过程应顺利进行,推进过程中出现推进不顺畅,动物甩尾或腿跳动等现象都反映插入不良,可稍微抽出导管并尝试再次插入。
4,缝线不要太紧,因为如果缝线太紧,可能会影响导管的通透性。