原代皮层和海马神经元培养实验全解析
原代皮层和海马神经元培养
神经科学作为一个重要的学科,研究神经元的功能和结构对于了解人类大脑的工作机制以及治疗神经退行性疾病具有重要意义。
原代皮层和海马神经元培养实验是神经科学研究中的一种常见实验方法,通过培养神经元,我们可以研究它们在不同生理和病理状态下的行为和功能。本次我们将详细介绍原代皮层和海马神经元培养的实验全流程,从神经元的获取、培养、观察等各个环节,为神经科学研究者提供实用的实验指导和参考。
01、培养前准备:
• 高压灭菌:器械包,枪头盒(1mL,200ul,10ul),纱布,超纯水。提前高压灭菌,灭菌后的物品尽量在 1 周内使用。
• 细胞板包被:用 0.1mg/mL 多聚赖氨酸(货号:sigma:P1024)提前 1-2 天包被细胞板,次日用超纯水清洗细胞板 3 次,培养箱中烘干备用。
• 细胞培养基配备:
含FBS 的DMEM:
DMEM 40mL+F-12 5mL+FBS 5mL+双抗 500ul
Neurobasal:Neurobasal 48.5mL+B27 1mL+谷氨酰胺 250ul(0.5mM)
02、动物:购买孕鼠(孕 16-18 天)或 1-3 天新生鼠。

03、紫外消毒工作台,之前高压灭菌的器械包,枪头盒,纱布,超纯水等。工作台和细胞间的紫外同时开启 30 min 后,通风 10 min。
04、取胎鼠:酒精消毒工作台,气体麻醉孕鼠,以“Y”字形剪开孕鼠下腹部, 取出完整子宫,避免子宫破裂。将完整的子宫放入一个干净的器皿(10 cm 细胞皿),酒精消毒器皿外部后,转移至细胞房。
05、取胎鼠脑:将所有的胎鼠脑全部取出,放入一个装满 DMEM 的 10 cm 皿内,10 cm 皿放在 1 个冰盒上(新生鼠则泡酒精后直接取脑)。
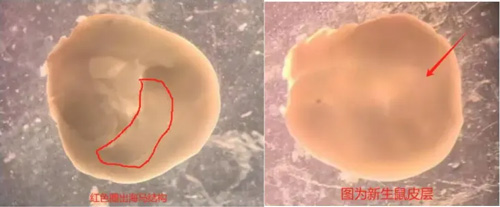
06、显微镜下分离提取脑海马或皮层组织:取一个胎鼠脑至 35mm 的小皿中,皿内装有 DMEM,将胎鼠脑放置为背侧面朝上,用镊子沿中线分开左右两侧, 用镊子固定住胎鼠脑,用另外 1 个镊子将皮质向外侧拨开,暴露出海马,剥离血管膜(尽量剥干净可有效减少成纤维细胞干扰),分离出海马段。将分离出的海马段放置于一个 35mm 小皿内,小皿装有 DMEM,小皿放在冰盒上。
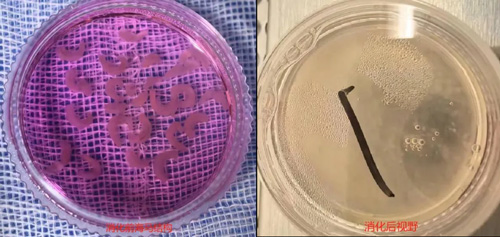
07、胰酶消化海马组织。将装有全部海马组织的小皿转移至超净工作台操作,放在一个冰盒上操作,将小皿侧放,用 1mL 枪吸干净皿内 DMEM,然后用眼科剪将海马剪碎,约剪成 1mm3 的肉糜状,加入适量的胰酶(一般 1 只孕鼠取出的胎鼠海马,用 2mL 胰酶),适当将海马组织碎摇匀散开,尽快放入至 37°培养箱,消化 15min。若组织较多,适当加长消化时间。
08、终止消化。将小皿取回至工作台的冰盒上,加入 2mL DMEM 终止消化,将皿内所有液体转移至一个 15mL 离心管。
09、离心。用 1mL 枪吹打混匀海马组织悬液,1500rpm,离心 3min,需要用另外一个 15 mL 离心管装 4mL 废液进行配平。

10、制备细胞悬液:将离心后的离心管取出,弃去上清液,留沉淀,加入 1mL DMEM,用 1mL 枪头吹打均匀,约吹打 10-15 次,静置 1min 后,取上清液至一个新的 15mL 离心管,这一步重复 2 遍,将获得 3-4mL 细胞悬液。
11、种板:用含 FBS 的 DMEM 制备合适的种板细胞悬液,种板。6 孔板种板密度为 7.5 X105 个/mL,12 孔板种板密度为 4X105 个/mL。放入 37℃培养箱培养。
12、4-6 h 后换液,将含 FBS 的 DMEM 全部换为 Neurobasal。
13、细胞换液。一般 2 天换液一次,建议第 2 天进行阿糖胞苷处理。24h 后用Neurobasal 全量换液,第 7-8 天进行 OGD 或其他后续处理。
14、可用 MAP2 进行神经元的纯度验证,如下图:
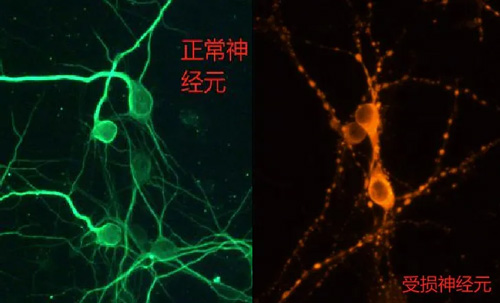
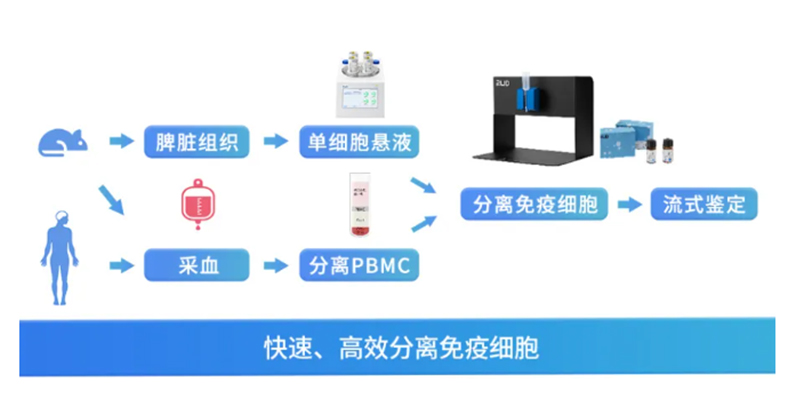
脑组织解离不止有手工酶解方法,【RWD单细胞悬液制备仪】全自动解离神经组织助力用户神经研究。可以将大小鼠脑组织温和、快速、高效地制备成单细胞悬液,同时保留细胞重要的表面抗原表位。获得的单细胞悬液可继续用于原代细胞培养或细胞分选等下游实验应用。